USP 2007 Química - Questões
Abrir Opções Avançadas
Foi realizado o seguinte experimento, em quatro etapas:
I. Em um copo de vidro, contendo alguns pregos de ferro lixados, foi colocada uma solução de tintura de iodo (iodo em solução de água e álcool comum, de cor castanho-avermelhada), em quantidade suficiente para cobrir os pregos. Depois de algumas horas, observou-se descoloração da solução.
II. A solução descolorida foi despejada em um outro copo, separando-se-a dos pregos.
III. À solução descolorida, foram adicionadas algumas gotas de água sanitária (solução aquosa de hipoclorito de sódio, cujo pH é maior que 7). Observou-se o reaparecimento imediato da cor castanho-avermelhada e formação de um precipitado.
IV. Adicionaram-se, à mistura heterogênea obtida em III, algumas gotas de ácido clorídrico concentrado. A solução continuou castanho-avermelhada, mas o precipitado foi dissolvido.
Observações:
Hipoclorito, $C\ell O^-$, é um oxidante que se reduz a cloreto, $C{\ell }^-$, em meio aquoso.
O precipitado da etapa III envolve o cátion formado na etapa I.
Na tintura de iodo, o álcool está presente apenas para aumentar a solubilidade do iodo.
a) Escreva a equação química balanceada para a reação que ocorre na etapa I.
b) Quais os produtos das transformações que ocorrem na etapa III?
c) Escreva a equação química balanceada para a reação que ocorre na etapa IV.
A Agência Nacional do Petróleo (ANP) estabelece que o álcool combustível, utilizado no Brasil, deve conter entre 5,3% e 7,4% de água, em massa. Porcentagens maiores de água significam que o combustível foi adulterado. Um método que está sendo desenvolvido para analisar o teor de água no álcool combustível consiste em saturá-lo com cloreto de sódio, $NaC\ell$, e medir a condutividade elétrica da solução resultante. Como o $NaC\ell$ é muito solúvel em água e pouco solúvel em etanol, a quantidade de sal adicionada para saturação aumenta com o teor de água no combustível. Observa-se que a condutividade elétrica varia linearmente com o teor de água no combustível, em um intervalo de porcentagem de água que abrange os limites estabelecidos pela ANP.
a) Explique por que o etanol $(CH_3CH_2OH)$ forma mistura homogênea com água em todas as proporções.
b) Faça um desenho, representando os íons $Na^+$ e $C{\ell }^-$ em solução aquosa e mostrando a interação desses íons com as moléculas de água.
c) Esboce um gráfico que mostre a variação da condutividade elétrica da mistura combustível, saturada com $NaC\ell$, em função do teor de água nesse combustível. Justifique por que o gráfico tem o aspecto esboçado.
O Brasil é campeão de reciclagem de latinhas de alumínio. Essencialmente, basta fundi-las, sendo, entretanto, necessário compactá-las, previamente, em pequenos fardos. Caso contrário, o alumínio queimaria no forno, onde tem contato com oxigênio do ar.
Dados:
massas molares ($g/mol$) $$Cu\ =\ 63,5$$ $$C\ell \ =\ 35,5$$
a) Escreva a equação química que representa a queima do alumínio.
b) Use argumentos de cinética química para explicar por que as latinhas de alumínio queimam, quando jogadas diretamente no forno, e por que isso não ocorre, quando antes são compactadas? Uma latinha de alumínio vazia pode ser quebrada em duas partes, executando-se o seguinte experimento: - Com uma ponta metálica, risca-se a latinha em toda a volta, a cerca de 3 cm do fundo, para remover o revestimento e expor o metal. - Prepara-se uma solução aquosa de $CuC{\ell }_2$, dissolvendo-se 2,69 g desse sal em 100 mL de água. Essa solução tem cor verde-azulada. - A latinha riscada é colocada dentro de um copo de vidro, contendo toda a solução aquosa de $CuC{\ell }_2$, de tal forma a cobrir o risco. Mantém-se a latinha imersa, colocando-se um peso sobre ela. Após algum tempo, observa-se total descoramento da solução e formação de um sólido floculoso avermelhado tanto sobre o risco, quanto no fundo da latinha. Um pequeno esforço de torção sobre a latinha a quebra em duas partes.
c) Escreva a equação química que representa a transformação responsável pelo enfraquecimento da latinha de alumínio.
d) Calcule a massa total do sólido avermelhado que se formou no final do experimento, ou seja, quando houve total descoramento da solução.
Um centro de pesquisa nuclear possui um cíclotron que produz radioisótopos para exames de tomografia. Um deles, o Flúor-18 $(\ ^{18}_{\ }F)$, com meia-vida de aproximadamente 1h30min, é separado em doses, de acordo com o intervalo de tempo entre sua preparação e o início previsto para o exame. Se o frasco com a dose adequada para o exame de um paciente $A$, a ser realizado 2 horas depois da preparação, contém $N_A$ átomos de $\ ^{18}_{\ }F$, o frasco destinado ao exame de um paciente $B$, a ser realizado 5 horas depois da preparação, deve conter $N_B$ átomos de $\ ^{18}F$, com
A meia vida de um elemento radioativo é o intervalo de tempo após o qual metade dos átomos inicialmente presentes sofreram desintegração.
A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico.
Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo $Na^+_{\ \ \left(aq\right)}$ e $Cl^-_{\ \ \left(aq\right)}.$
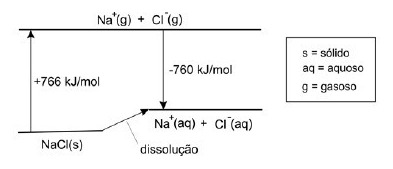
Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal
Carregando...