USP 2021 Química - Questões
Abrir Opções Avançadas
Recentemente, um estudo científico associou a detecção de fosfina $(\text{PH}_3)$ na atmosfera em Vênus com uma possível existência de vida no planeta. Na Terra, a fosfina pode ser encontrada naturalmente em ambientes onde ocorre a degradação de matéria orgânica, como pântanos. Por ser mais densa que o ar, grande quantidade de fosfina se acumula sobre as superfícies de corpos d’água e áreas baixas, muitas vezes reagindo espontaneamente com oxigênio, formando ácido fosfórico $(\text{H}_3\text{PO}_4)$.
a) Utilizando os menores coeficientes estequiométricos inteiros possíveis, escreva a equação balanceada para o processo de combustão descrito para a fosfina.
b) Os ambientes onde se encontram altas quantidades de fosfina são compatíveis com a vida de seres aeróbios ou anaeróbios? Justifique sua resposta com base na reatividade da fosfina.
c) Em ambientes como os pântanos, além da fosfina, também é produzido metano $(\text{CH}_4)$. Com base na energia de ativação e na energia liberada na combustão de cada espécie, explique por que a combustão da fosfina é a primeira a ocorrer na natureza e por que ela é capaz de iniciar a combustão do metano.
Note e adote:
Energia de ativação da combustão: fosfina $= 13\ \text{kJ/mol}$ e metano $= 105\ \text{kJ/mol}$.
$\Delta H$ de combustão: fosfina $= -1154\ \text{kJ/mol}$ e metano $= - 885\ \text{kJ/mol}$.
O teor de carbonato de cálcio $(\text{CaCO}_3)$, usado como abrasivo em cremes dentais, pode ser determinado por meio da chamada retrotitulação. Nesse método, adiciona-se excesso de $\text{HC}\ell$, resultando na completa dissolução do $\text{CaCO}_3$ (reação $\text{I}$); em seguida, titula-se o que sobrou de $\text{HC}\ell$ com NaOH até a neutralização da solução (reação $\text{II}$). Sabendo-se a quantidade de NaOH, pode-se calcular o número de mols que sobrou de $\text{HC}\ell$. Pela diferença entre o que sobrou de $\text{HC}\ell$ e o número de mols inicial de $\text{HC}\ell$, é possível determinar o teor de $\text{CO}_3^{2-}$ na amostra.
$$(\text{reação I})\ {\text{CaCO}_3}_{(\text{s})} + 2\ \text{HC}\ell_{(aq)} \rightarrow {\text{CaC}\ell_2}_{(aq)} + {\text{H}_2\text{O}}_{(\ell)} + {\text{CO}_2}_{(g)}$$
$$(\text{reação II})\ {\text{HC}\ell}_{(aq)} + \text{NaOH}_{(aq)} \rightarrow {\text{NaC}\ell}_{(aq)} + {\text{H}_2\text{O}}_{(\ell)}$$
Para estudar uma amostra, o seguinte procedimento foi realizado:
Etapa $1$: Pesagem de $5,0 \ \text{g}$ de creme dental comercial.
Etapa $2$: Adição de $20,0 \ \text{ml}$ de solução $2,0 \ \text{mol} \cdot L^{-1}$ de HC$\ell$, seguida por agitação e aquecimento até que a reação $\text{I}$ se complete.
Etapa $3$: Após a solução esfriar, adição de água à solução $2$ até completar um volume final de $50,0\ \text{mL}$ e agitação.
Etapa $4$: Titulação do HC$\ell$ presente na amostra com NaOH $0,5\ \text{mol} \cdot L^{-1}$ até a completa neutralização (reação $\text{II}$).
Etapa $5$: Medida do volume de NaOH usado para titulação. Resultado: $\underline{\text{Volume de NaOH usado} = 30,0\ \text{mL}}.$
a) Cite a importância do aquecimento na etapa $2$.
b) Alguns cremes dentais usam dióxido de silício $(\text{SiO}_2)$ como abrasivo em vez de $\text{CaCO}_3$. Para esses produtos, o mesmo procedimento de retrotitulação serviria para calcular o teor do abrasivo $(\text{SiO}_2)$? Justifique.
c) Calcule a porcentagem em massa (massa de $\text{CaCO}_3$ por massa de creme dental) de abrasivo na amostra estudada, conforme os valores dados no procedimento.
Note e adote:
Considere que não há qualquer outra espécie ácida ou básica no creme dental em quantidade suficiente para interferir no procedimento. Massa molar $(\text{g/mol})$: $\text{CaCO}_3 = 100$.
$\text{SiO}_2$ é um óxido ácido.
Psicanálise do açúcar
O açúcar cristal, ou açúcar de usina, mostra a mais instável das brancuras: quem do Recife sabe direito o quanto, e o pouco desse quanto, que ela dura. Sabe o mínimo do pouco que o cristal se estabiliza cristal sobre o açúcar, por cima do fundo antigo, de mascavo, do mascavo barrento que se incuba; e sabe que tudo pode romper o mínimo em que o cristal é capaz de censura: pois o tal fundo mascavo logo aflora
quer inverno ou verão mele o açúcar.
Só os banguês* que-ainda purgam ainda o açúcar bruto com barro, de mistura; a usina já não o purga: da infância, não de depois de adulto, ela o educa; em enfermarias, com vácuos e turbinas, em mãos de metal de gente indústria, $\underline{a\ usina\ o\ leva\ a\ sublimar\ em\ cristal{}}$ $\underline{o\ pardo\ do\ xarope{}}$: não o purga, cura. Mas como a cana se cria ainda hoje, em mãos de barro de gente agricultura, o barrento da pré-infância logo aflora
quer inverno ou verão mele o açúcar.
(João Cabral de Melo Neto, A Educação pela Pedra.)
* banguê: engenho de açúcar primitivo movido a força animal.
Observe o diagrama que mostra, de forma simplificafada, o professo de fabricação do açúcar.
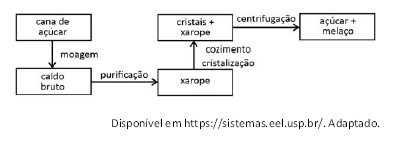
Disponível em https://sistemas.eel.usp.br/.Adaptado.
Considerando essas informações e seu conhecimento sobre separação de misturas e transformações químicas e físicas, no trecho grifado no poema, o termo sublimar é usado.

Disponível em: http://twitter.com/DoutorQuimica/.
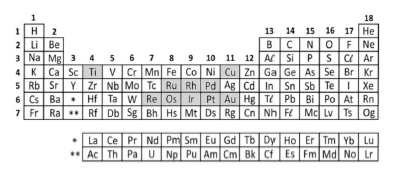
O meme ao lado brinca com os conceitos de química em um jogo popular, cujo objetivo é que os jogadores descubram o impostor entre os tripulantes de naves e estações espaciais. Nele um dos elementos é considerado o impostor por sua característica química diferente.
Nesse contexto, é correto afirmar que o impostor seria o elemento:
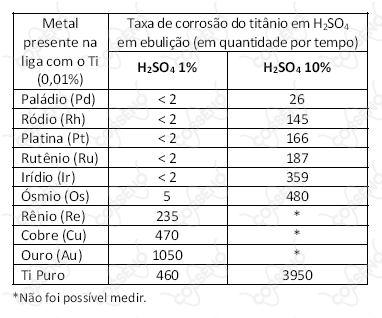
Um experimento expôs uma barra de titânio (Ti) pura e ligas desse material com $0,01\%$ de diferentes metais nobres a soluções de ácido sulfúrico em ebulição para entender o efeito anticorrosivo desses metais no titânio. O resultado é mostrado na tabela a seguir:
Com base nessas informações, é correto afirmar:
Carregando...