UNIFESP 2009 Química - Questões
Abrir Opções Avançadas
O ácido nítrico é um dos ácidos mais utilizados na indústria e em laboratórios químicos. É comercializado em diferentes concentrações e volumes, como frascos de 1 litro de solução aquosa, que contém 60% em massa de $HNO_3$ (massa molar $63\ \text{g/mol}$). Por se tratar de ácido forte, encontra-se totalmente na forma ionizada quando em solução aquosa diluída. É um líquido incolor, mas adquire coloração castanha quando exposto à luz, devido à reação de fotodecomposição. Nesta reação, o ácido nítrico decompõe-se em dióxido de nitrogênio, gás oxigênio e água.
a) Escreva as equações químicas, devidamente balanceadas, da reação de fotodecomposição do ácido nítrico e da ionização do ácido nítrico em meio aquoso.
b) A 20$\ ^\circ$C, a solução aquosa de ácido nítrico descrita apresenta concentração $13,0\ \text{mol/L}$. Qual é a densidade desta solução nessa mesma temperatura? Apresente os cálculos efetuados.
A oxigenoterapia, tratamento terapêutico com gás oxigênio, é indicada para pacientes que apresentam falta de oxigênio no sangue, tais como portadores de doenças pulmonares. O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão, nas condições mostradas na figura.
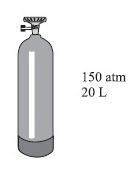
No cilindro, está indicado que o conteúdo corresponde a um volume de $3\ m^3$ de oxigênio nas condições ambientes de pressão e temperatura, que podem ser consideradas como sendo 1 $atm\ e\ 300\ \text{K}$, respectivamente.
Dado $R\ =\ 0,082\ \text{atm.L.K}^{-1}.\text{mol}^{-1}$, a massa de oxigênio, em $\text{kg}$, armazenada no cilindro de gás representado na figura é, aproximadamente,
O $CaCO_3$ é um dos constituintes do calcário, importante matéria-prima utilizada na fabricação do cimento. Uma amostra de $7,50\ \text{g}$ de carbonato de cálcio impuro foi colocada em um cadinho de porcelana de massa $38,40\ \text{g}$ e calcinada a $900\ ^{\circ}\text{C}$, obtendo-se como resíduo sólido somente o óxido de cálcio. Sabendo-se que a massa do cadinho com o resíduo foi de 41,97 g, a amostra analisada apresenta um teor percentual de $CaCO_3$ igual a
O gráfico apresenta as primeiras e segundas energias de ionização (1 EI e 2 EI) para os elementos sódio, magnésio e cálcio, indicados como I, II e III, não necessariamente nessa ordem.
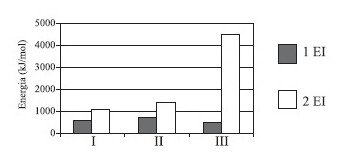
Dentre esses elementos, aqueles que apresentam os maiores valores para a primeira e para a segunda energia de ionização são, respectivamente,
Um composto iônico, a partir da concentração de sua solução aquosa saturada, a 25 $\ ^{o}$C, pode ser classificado de acordo com a figura, quanto à solubilidade em água.

Um litro de solução aquosa saturada de $PbSO_4$ (massa molar $303\ \text{g/mol}$), a $25\ ^\circ \text{C}$, contém $45,5\ \text{mg}$ de soluto. O produto de solubilidade do $CaCrO_4$ a $25\ ^ \circ \text{C}$ é $6,25 \times {10}^{-4}$. Quanto à solubilidade em água a $25\ ^\circ \text{C}$, os compostos $PbSO_4$ e $CaCrO_4$ podem ser classificados, respectivamente, como
Carregando...