ESPCEX 2020 Química - Questões
Abrir Opções Avançadas
Tratando-se da estrutura e fórmula molecular, aldeídos são substâncias orgânicas que apresentam em sua estrutura o grupo carbonila ligado a um átomo de hidrogênio, na ponta de uma cadeia carbônica.
Considere os seguintes aldeídos: metanal; etanal; propanal; $3$-metilbutanal e $2$-metilbutanal. Baseado nas fórmulas moleculares dos compostos citados, o aldeído que apresenta, em sua fórmula percentual, aproximadamente $54,5 \%$ em massa de carbono $(C)$ na sua estrutura é o
O oxalato de cálcio é oxidado por permanganato de potássio em meio ácido. A equação não balanceada dessa reação é representada a seguir:
$$\ce {CaC2O4 + KMnO4 + H2SO4 -> CaSO4 + K2SO4 + MnO2 + H2O + CO2}$$
A soma dos coeficientes da equação da reação corretamente balanceada (menores números inteiros) e o volume de $\ce {CO2}$ liberado quando se faz reagir $\pu {384 g}$ de oxalato de cálcio por reação completa, na condição ambiente $(\pu {25^\circ C}$e $\pu {1 atm})$, são, respectivamente
O fósforo branco, de fórmula $P_4$, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
$$\ce{2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) -> 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)}$$
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco $(P_4 )$ é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece $\pu{1860 g}$ de fosfato de cálcio com rendimento de $80\%$ é de $\pu{297,6 g}$.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: $1s^2 2s^2 2p^6 3s^2 3p^5$.
Das afirmativas feitas estão corretas apenas
O carbeto de cálcio, de fórmula $\ce{CaC2}$ , é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás acetileno (etino), de fórmula $\ce{C2H2}$, conforme mostra a equação, não balanceada, a seguir
$$\ce{CaC2 (s) + H2O (l) -> C2H2 (g) + Ca(OH)2 (s)} \ \ \ \ \ \ \ (\text{equação} 1 )$$
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
$$\ce{C2H2 (g) + O2 (g) -> CO2 (g) + H2O (g) + calor} \ \ \ \ \ \ \ (\text{equação} 2 )$$
Uma massa de $\pu{512 g}$ de carbeto de cálcio com pureza de $50\%$ (e $50\%$ de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes $(25^\circ C$ e $\pu{1 atm})$, o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
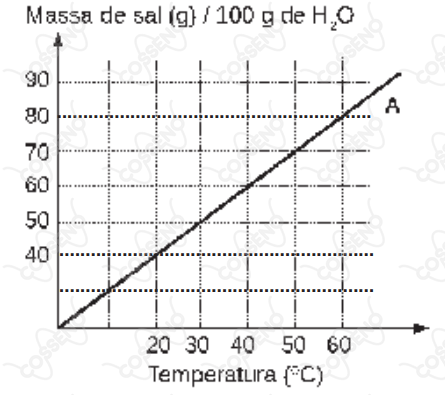
Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético $A$. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal $A$) em $\pu{100 g}$ de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de $\pu{20 ºC}$, misturando-se $\pu{50 g}$ do sal $A$ em $\pu{100 g}$ de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de $40^\circ C$, a adição de $\pu{50 g}$ do sal $A $ em $\pu{100 g}$ de água produzirá uma solução insaturada.
III – $\pu{200 g}$ de água dissolvem totalmente $\pu{90 g}$ do sal $A$ a $30^\circ C$.
IV – Uma solução contendo $\pu{60 g}$ do sal $A$ em $\pu{100 g}$ de água será saturada em $60^\circ C$.
Das afirmativas feitas estão corretas apenas
Carregando...