Um estudante realizou uma diluição, conforme mostrado na figura abaixo.
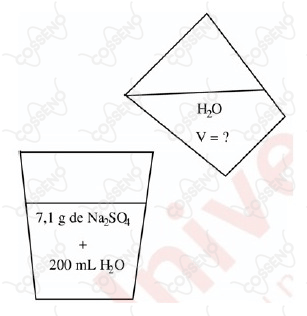
Supondo-se que a densidade da água, bem como da solução inicial, sejam de , qual será o volume de água a ser adicionado para que a solução passe a ter concentração de ?
CossenoGPT
Teste
gratuitamente agora
mesmo! 

Sabe-se que a massa do sulfato de sódio $Na_2SO_4=2\cdot 23 + 32 + 16\cdot 4 = 142$.
Portanto temos $7,1 \div 142 = 0,05$ mols de $Na_2SO_4$.
Pela equação fundamental da volumetria $$ M_a V_a = M_b V_b$$
Em que $M$ é a molaridade da solução. (Mols por litro)
Assim percebe-se que podemos resolver por simples substituição:
$$ M_a = 0,05 \div 200$$
$$ V_a = 200$$
$$ M_b = 0,2$$
$$ V_b = x$$
$$x = M_a\cdot V_a \div M_b = 250$$
Como temos $200$ ml na solução inicial, precisa-se adicionar $50$ ml.
$$Alternativa(B)$$

