Um cilindro contém oxigênio à pressão de atmosferas e ocupa um volume de litros à temperatura de . O gás, cujo comportamento é considerado ideal, executa um ciclo termodinâmico através dos seguintes processos:
Processo : aquecimento à pressão constante até .
Processo : resfriamento à volume constante até .
Processo : resfriamento à pressão constante até .
Processo : aquecimento à volume constante até .
Ilustre os processos em um diagrama pressão-volume e determine o trabalho executado pelo gás, em Joules, durante o ciclo descrito acima. Determine, ainda, o calor líquido produzido ao longo deste ciclo.
Dado:
$1\text{ atm}=10^5\text{ Pa}$.
$1\text{ atm}=10^5\text{ Pa}$.
CossenoGPT
Teste
gratuitamente agora
mesmo! 

Inicialmente, temos: $$\begin{cases}P_1=\pu{2 atm}\\ V_1=\pu{3\cdot 10^{-3} m3}\\ T_1=\pu{300 K}\end{cases}$$
Após o primeiro processo, teremos $T_2=\pu{500 K}$ e: $$V_2=\dfrac{T_2}{T_1}V_1=5\cdot 10^{-3}\text{ m}^3$$
Após o segundo processo, teremos $T_3=\pu{250 K}$ e: $$P_3=\dfrac{T_3}{T_2}P_2=1\cdot 10^{5}\text{ Pa}$$
Como estamos lidando com um ciclo termodiâmico, já podemos determinar os valores de pressão e temperatura a ligando os pontos no diagrama PV, dado que o processo 3 é isobárico e o 4 é isocórico.
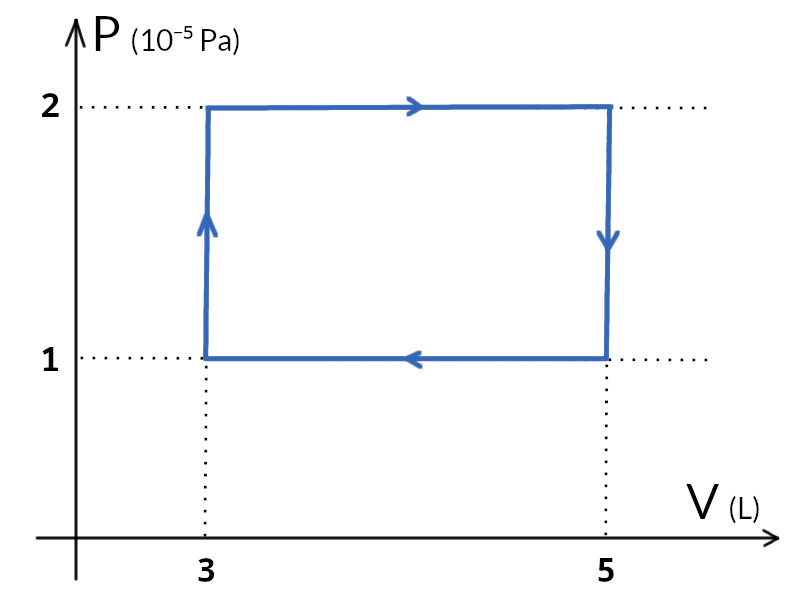 Assim, para calcular o trabalho basta calcular a área do retângulo acima: $$\begin{align*}&W=1\cdot 10^5\cdot 2\cdot 10^{-3}\\ &\boxed{W=\pu{200 J}}\end{align*}$$
Enquanto o calor líquido produzido ao longo do ciclo pode ser determinado pela primeira lei da termodinâmica: $$Q=\Delta U + W$$
Como estamos lidando com um ciclo, o estado final é igual ao inicial, e assim $\Delta U = 0$, fazendo com que o calor líquido também seja $Q=W=\pu{200 J}$.
Assim, para calcular o trabalho basta calcular a área do retângulo acima: $$\begin{align*}&W=1\cdot 10^5\cdot 2\cdot 10^{-3}\\ &\boxed{W=\pu{200 J}}\end{align*}$$
Enquanto o calor líquido produzido ao longo do ciclo pode ser determinado pela primeira lei da termodinâmica: $$Q=\Delta U + W$$
Como estamos lidando com um ciclo, o estado final é igual ao inicial, e assim $\Delta U = 0$, fazendo com que o calor líquido também seja $Q=W=\pu{200 J}$.

Ampliar Imagem

