A reação de sulfonação do naftaleno ocorre por substituição eletrofílica nas posições e do composto orgânico, de acordo com o diagrama de coordenada de reação a .
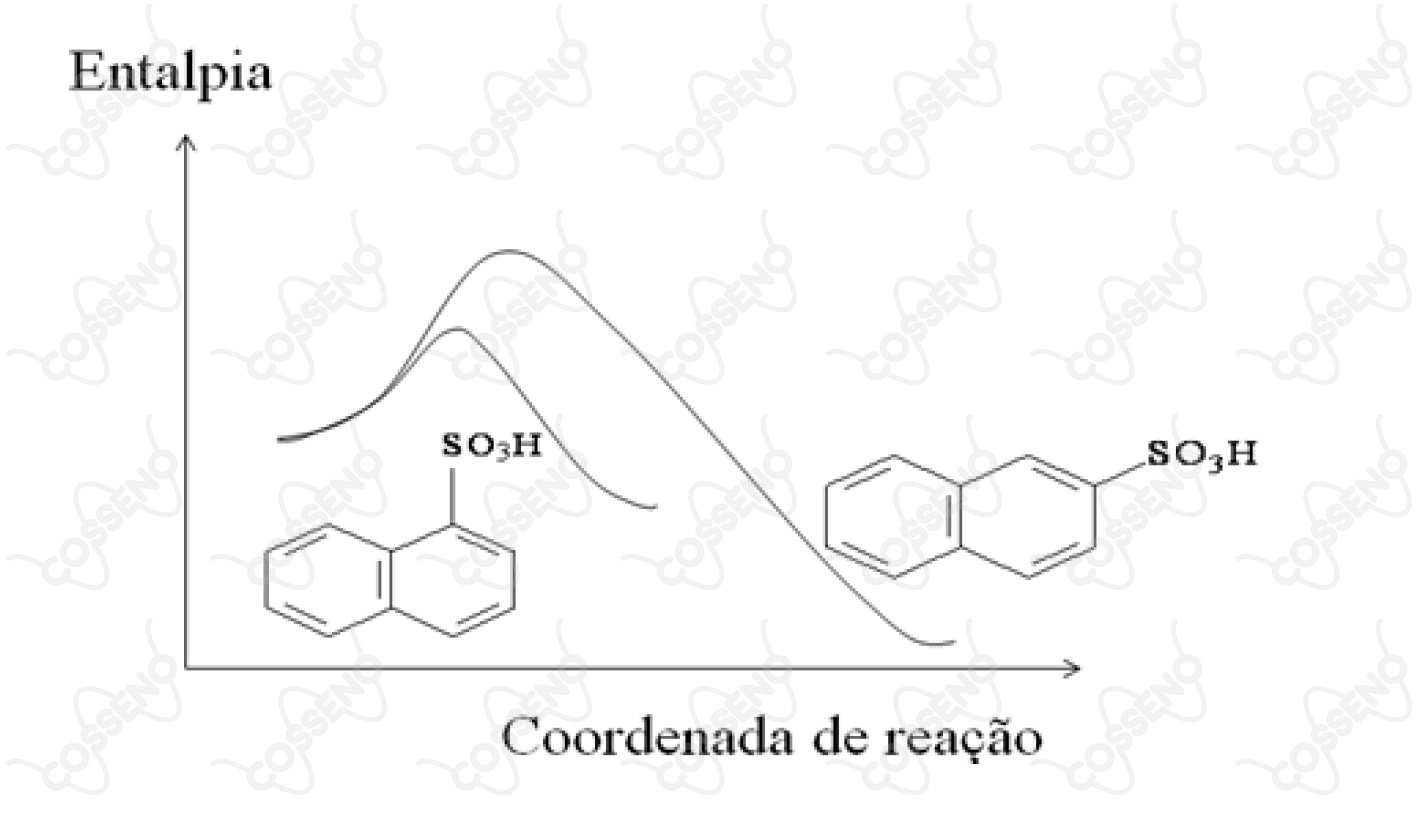
Com base neste diagrama, são feitas as seguintes afirmações:
I. A reação de sulfonação do naftaleno é endotérmica.
II. A posição do naftaleno é mais reativa do que a de .
III. O isômero é mais estável que o isômero .
Das afirmações acima, está(ão) CORRETA(S) apenas
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A princípio, deve-se saber quais são as posições $\alpha$ e $\beta$, que são mostradas, respectivamente, à esquerda e direita. Nesse sentido, vejamos as afirmativas:
$• \ \text{Afirmativa I:}$ $\color{orangered}{\text{Incorreta}}$
Conforme o gráfico, nota-se que a entalpia dos produtos é menor do que a dos reagentes, consequentemente, a reação é exotérmica $(\Delta H <0)$.
$• \ \text{Afirmativa II:}$ $\color{#3368b8}{\text{Correta}}$
Para que o composto reaja, é necessário que ele atinja um grau de energia chamado "energia de ativação", esta que se concentra no pico das curvas do gráfico. Com isso, é intuitivo dizer que quanto menor a energia necessária para formar o complexo ativado, mais reativo é o composto. Portanto, a posição $\alpha$ é mais reativa que a $\beta$.
$• \ \text{Afirmativa III:}$ $\color{#3368b8}{\text{Correta}}$
Estabilidade está intimamente ligada a energia do composto - quanto menor a energia, mais estável. Dessa forma, nota-se que o composto $\beta$ atinge uma posição de menor energia, consequentemente, mais estável.\begin{matrix}Letra \ (D)
\end{matrix}

