Nos gráficos abaixo, cada eixo representa uma propriedade termodinâmica de um gás que se comporta idealmente.
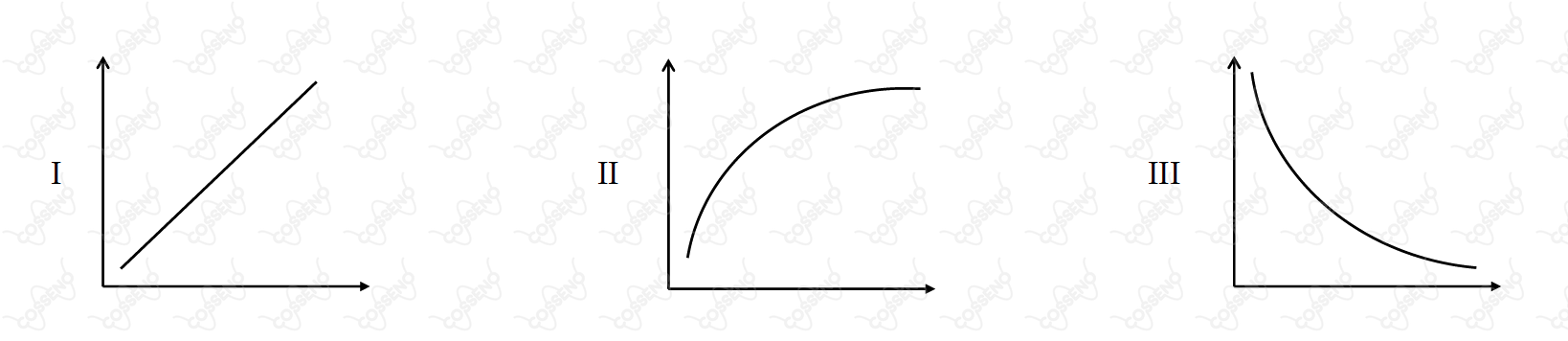
Com relação a estes gráficos, é CORRETO afirmar que
CossenoGPT
Teste
gratuitamente agora
mesmo! 

(A) - Errada
Pensemos na Equação de Clapeyron:
$$ P.V = n.R.T \Rightarrow P = \frac{1}{V}.n.R.T$$
Ou seja, P versus inverso do Volume formará uma linha reta.
$$ $$
(B) - Errada
Raciocínio análogo à alternativa A.
$$ $$
(C) - Correta
Capacidade Calorífica:
$$ Q = C.\Delta T \Rightarrow C = \frac{Q}{\Delta T} $$
O gráfico da capacidade calorífica pelo inverso da temperatura formaria uma reta, então na situação apresentada na alternativa formará a curva hiperbólica apresentada no item II.
$$ $$
(D) - Errada
Energia interna para um gás monoatômico ideal:
$$ U = \frac{3}{2} n.R.T $$
Ou seja, energia interna e temperatura formam uma linha reta.
$$ $$
(E) - Errada
Pensando na Primeira Lei da Termodinâmica:
$$ \Delta H = \Delta U + P.\Delta V $$
Ou seja, entalpia e produto da pressão por volume devem formar uma linha reta.

