Considere as reações químicas representadas pelas equações abaixo:
I.
II.
III.
IV.
V.
Assinale a opção que apresenta as equações químicas que configuram reações de óxido-redução.
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A questão é relativamente simples de se responder caso você tenha conhecimento que toda oxidação evoca uma redução. Nesse contexto, uma forma direta de resolver seria verificar apenas uma oxidação ou redução, visto que uma veicula a outra.
$• \ \text{Reação I:}$ $\color{#3368b8}{\text{Redox}}$
Pensando em facilitar a análise, podemos escrever a reação conforme projeções de Kekulé:
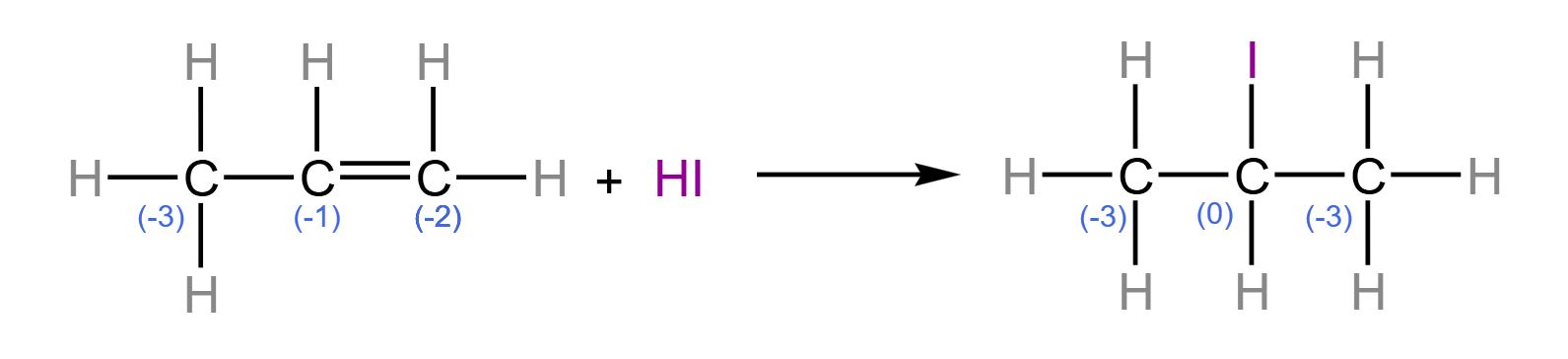 A ideia aqui é averiguar o NOX dos carbonos, em que se percebe uma auto oxirredução, atuando apenas os átomos de carbono.
$\color{orangered}{\text{Obs:}}$ Verificar o NOX dos átomos de carbono não é uma tarefa difícil, mas requer o conhecimento de oxirreduções, assim como um pouco de eletronegatividade. Com isso, observe que o primeiro carbono - da esquerda para direita - apresenta quatro ligantes. Nesse sentido, sendo o hidrogênio menos eletronegativo que o carbono, este último desloca os elétrons para ele, fazendo o hidrogênio "perder" um elétron, como são três, o carbono "recebe" três elétrons. Há ainda a ligação carbono-carbono, mas esta é covalente pura, ou seja, não há diferença de eletronegatividade, isto é, não influencia no NOX. (Afinal, os elétrons não são deslocados). Analogamente, o raciocínio segue para os demais carbonos subsequentes.
$• \ \text{Reação II:}$ $\color{orangered}{\text{Não é Redox}}$
O raciocínio é análogo ao anterior, mas note que se trata de uma neutralização, em que o NOX das espécies não varia.
$• \ \text{Reação III:}$ $\color{#3368b8}{\text{Redox}}$
A análise desta reação é um pouco mais complexa que as demais, mas nada inviável, pois a ideia seria verificar que o carbono da propanona $\ce{(H_3C)_2CO}$ reduz. Nesse sentido, pensando no complexo - hidreto de alumínio e lítio - têm-se:
A ideia aqui é averiguar o NOX dos carbonos, em que se percebe uma auto oxirredução, atuando apenas os átomos de carbono.
$\color{orangered}{\text{Obs:}}$ Verificar o NOX dos átomos de carbono não é uma tarefa difícil, mas requer o conhecimento de oxirreduções, assim como um pouco de eletronegatividade. Com isso, observe que o primeiro carbono - da esquerda para direita - apresenta quatro ligantes. Nesse sentido, sendo o hidrogênio menos eletronegativo que o carbono, este último desloca os elétrons para ele, fazendo o hidrogênio "perder" um elétron, como são três, o carbono "recebe" três elétrons. Há ainda a ligação carbono-carbono, mas esta é covalente pura, ou seja, não há diferença de eletronegatividade, isto é, não influencia no NOX. (Afinal, os elétrons não são deslocados). Analogamente, o raciocínio segue para os demais carbonos subsequentes.
$• \ \text{Reação II:}$ $\color{orangered}{\text{Não é Redox}}$
O raciocínio é análogo ao anterior, mas note que se trata de uma neutralização, em que o NOX das espécies não varia.
$• \ \text{Reação III:}$ $\color{#3368b8}{\text{Redox}}$
A análise desta reação é um pouco mais complexa que as demais, mas nada inviável, pois a ideia seria verificar que o carbono da propanona $\ce{(H_3C)_2CO}$ reduz. Nesse sentido, pensando no complexo - hidreto de alumínio e lítio - têm-se:
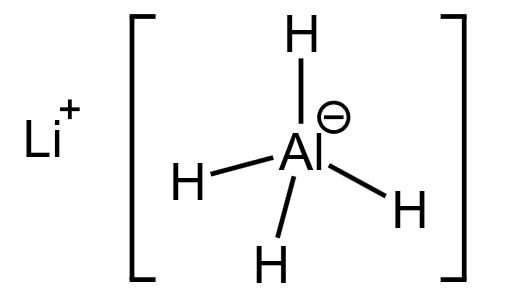 Observe que o alumínio é menos eletronegativo que o hidrogênio, assim, os átomos de hidrogênio deslocam os elétrons do alumínio para eles - assim fazendo o alumínio "perder" elétrons. Dessa forma, os átomos de hidrogênio apresentam NOX $-1$, sendo estes a sofrerem oxidação.
$• \ \text{Reação IV:}$ $\color{orangered}{\text{Não é Redox}}$
O raciocínio segue como em $\text{II}$, há uma dupla-troca em que nenhum elemento varia seu NOX.
$• \ \text{Reação V:}$ $\color{orangered}{\text{Não é Redox}}$
Novamente, o NOX das espécies não varia, há apenas um dupla-troca.\begin{matrix}Letra \ (B)
\end{matrix}
Observe que o alumínio é menos eletronegativo que o hidrogênio, assim, os átomos de hidrogênio deslocam os elétrons do alumínio para eles - assim fazendo o alumínio "perder" elétrons. Dessa forma, os átomos de hidrogênio apresentam NOX $-1$, sendo estes a sofrerem oxidação.
$• \ \text{Reação IV:}$ $\color{orangered}{\text{Não é Redox}}$
O raciocínio segue como em $\text{II}$, há uma dupla-troca em que nenhum elemento varia seu NOX.
$• \ \text{Reação V:}$ $\color{orangered}{\text{Não é Redox}}$
Novamente, o NOX das espécies não varia, há apenas um dupla-troca.\begin{matrix}Letra \ (B)
\end{matrix}

Ampliar Imagem

Ampliar Imagem

