Considere sejam feitas as seguintes afirmações a respeito das formas cristalinas do carbono:
I. As formas polimórficas do carbono são: diamante, grafite e fulerenos.
II. O monocristal de grafite é bom condutor de corrente elétrica em uma direção, mas não o é na direção perpendicular à mesma.
III. O diamante é uma forma polimórfica metaestável do carbono nas condições normais de temperatura e pressão.
IV. No grafite, as ligações químicas entre os átomos de carbono são tetraédricas.
Então, das afirmações acima, está(ão) CORRETA(S)
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Afirmativa I:}$ $\color{#3368b8}{\text{Correta}}$
Basicamente, esta são as três formas alotrópicas do carbono.
$• \ \text{Afirmativa II:}$ $\color{#3368b8}{\text{Correta}}$
A grafita apresenta estrutura de camadas com rede hexagonal em que os carbonos apresentam hibridação $sp^2$, estas redes são semelhantes a "tela de galinheiro". Nesse contexto, estas camadas são como condutores bidimensionais - por isso às vezes se refere ao grafite como um metal bidimensional - elas permitem o fluxo de elétrons na molécula, porém, como já se deve supor, este fluxo é paralelo ao plano, sendo ínfimo na direção perpendicular (cerca de $10^5$ menor). Veja a estrutura mais comum do grafite:
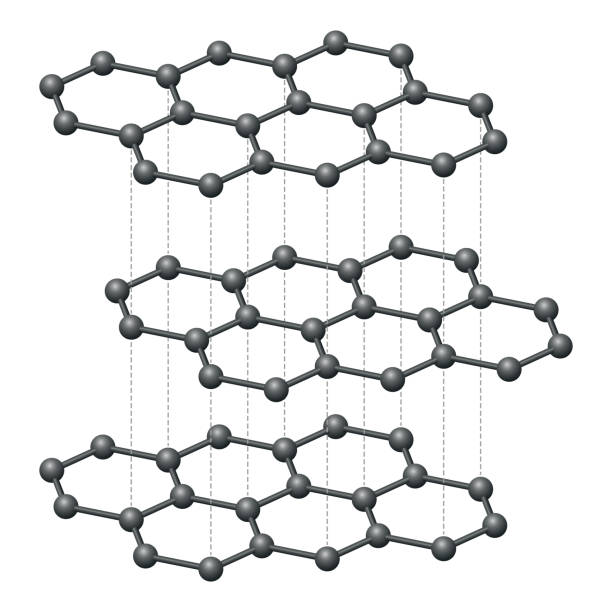 $• \ \text{Afirmativa III:}$ $\color{#3368b8}{\text{Correta}}$
Por metaestável, nos admitimos que ela não é a mais estável em condições normais (CNTP), o que é uma verdade, visto que a forma mais estável é a grafita. Contudo, vale ressaltar que a diferença de estabilidade é por uma margem restrita, o que é notório pelo fato de a transformação diamante-grafita ser muito lenta. (Afinal, você não espera que o grafite do seu lápis vire um diamante, certo?).
$• \ \text{Afirmativa IV:}$ $\color{orangered}{\text{Incorreta}}$
Como visto anteriormente, as ligações apresentam hibridação $sp^2$, a $sp^3$ (tetraédrica) é a do diamante.\begin{matrix}Letra \ (A)
\end{matrix}
$• \ \text{Afirmativa III:}$ $\color{#3368b8}{\text{Correta}}$
Por metaestável, nos admitimos que ela não é a mais estável em condições normais (CNTP), o que é uma verdade, visto que a forma mais estável é a grafita. Contudo, vale ressaltar que a diferença de estabilidade é por uma margem restrita, o que é notório pelo fato de a transformação diamante-grafita ser muito lenta. (Afinal, você não espera que o grafite do seu lápis vire um diamante, certo?).
$• \ \text{Afirmativa IV:}$ $\color{orangered}{\text{Incorreta}}$
Como visto anteriormente, as ligações apresentam hibridação $sp^2$, a $sp^3$ (tetraédrica) é a do diamante.\begin{matrix}Letra \ (A)
\end{matrix}

Ampliar Imagem

