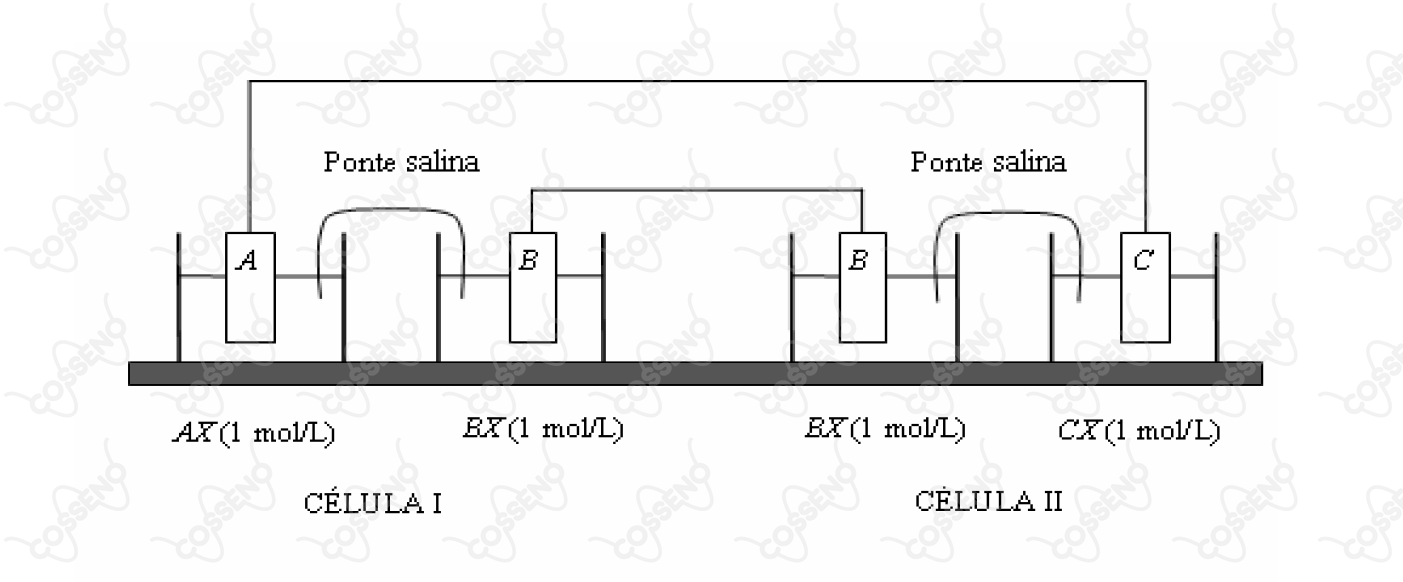
Duas células (I e II) são montadas como mostrado na figura. A célula I consiste de uma placa mergulhada em uma solução aquosa em , que está interconectada por uma ponte salina a uma solução em , na qual foi mergulhada a placa . A célula II consiste de uma placa mergulhada em uma solução aquosa em , que está interconectada por uma ponte salina à solução em , na qual foi mergulhada a placa . Considere que durante certo período as duas células são interconectadas por fios metálicos, de resistência elétrica desprezível. Assinale a opção que apresenta a afirmação ERRADA a respeito de fenômenos que ocorrerão no sistema descrito.
Dados eventualmente necessários:
$E^\circ _{A+(aq)/A(c)} = 0,400\ V; E^\circ _{B+(aq)/B(c)} = −0,700\ V$ e $E^\circ _{C+(aq)/C(c)} = 0,800\ V$.
$E^\circ _{A+(aq)/A(c)} = 0,400\ V; E^\circ _{B+(aq)/B(c)} = −0,700\ V$ e $E^\circ _{C+(aq)/C(c)} = 0,800\ V$.
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A princípio, podemos analisar em partes, isto é, analisar as conexões entre os eletros. Primeiramente, nota-se que o vínculo entre $A$ e $C$, são eles que irão ditar como o processo deve ocorrer. (Você pode perceber isso ao analisar a conexão de $B$ com $B$, pois, a priori, seu potencial deve ser zero, sendo completamente refém do processo de $A$ com $C$) Nesse sentido, as nossas células são galvânicas, sendo-as assim dependentes das espontaneidades entre as reações para funcionar. Com isso, pensando nos dados do enunciado, têm-se:\begin{matrix}
\ce{A+ + e- -> A &,& Eº_{A+/A} = 0,400} \\
\ce{C+ + e- -> C &,& Eº_{A+/A} = 0,800}
\end{matrix}Observe que o potencial de redução da espécie $C$ é maior, logo, esta deve prevalecer a fim de o processo ser espontâneo. Em suma, já podemos escrever:\begin{matrix}
\text{Eletrodo C:} & \text{Cátodo} \\
\text{Eletrodo A:} & \text{Ânodo}
\end{matrix}Agora, para os eletrodos $B$, é importante lembrar o conceito de $\text{corrente iônica}$, em que o fluxo de elétrons deve ser preservado a fim de não haver acúmulo ou consumo de carga, o que consequentemente cessaria o processo após determinado tempo. Desse modo, vamos pensar em $C$, nele ocorre a redução, seus respectivos cátions devem reduzir, ou seja, a carga positiva do meio irá diminuir, assim, a fim de manter a eletroneutralidade do processo, um fluxo de carga positiva deve adentrar o processo, mas como? Ora, pela ponte salina, junto a $B$ na célula $\ce{II}$, com o passar do tempo ela $(B)$ deve se oxidar a fim de depositar íons em solução e estes serem transportados pela ponte salina - preservando a corrente iônica. Analogamente, como o $B$ da segunda célula deve oxidar, o $B$ da primeira deve reduzir, e então constatamos:\begin{matrix}
\text{Eletrodo B I:} & \text{Cátodo} \\
\ \ \text{Eletrodo B II:} & \text{Ânodo}
\end{matrix}$\color{orangered}{\text{Obs:}}$ Um bom exercício seria tentar justificar o resultado anterior partindo por $A$ em vez de $C$.
$\color{}{\text{Nota:}}$ A manutenção dos íons em solução, isto é, seu consumo e deposição irá alterar o potencial das espécies, por exemplo, ao se acumular carga positiva no ânodo, será mais difícil a saída dos elétrons - o potencial será menor para oxidação - visto que a carga positiva próxima do ânodo deve tentar aprisionar os elétrons (no ânodo) com o intuito de trazê-los para eles - os cátions. (Você pode verificar isso quantitativamente jogando alguns números na Equação de Nernst.) Além disso, pense num circuito elétrico, mas este é composto por partes externas com os condutores conectados, assim como partes inteiras - fases líquidas - que compõem a corrente iônia e as pontes salinas, ao passo que um processo não ocorre, estamos "desconectando" o circuito.
Por fim, analisando as alternativas:
$• \ \text{Alternativa (A):}$ $\color{#3368b8}{\text{Correta}}$
Como em $C$ ocorre redução, sua massa deve aumentar.
$• \ \text{Alternativa (B):}$ $\color{#3368b8}{\text{Correta}}$
Correto, visto que ela é um ânodo.
$• \ \text{Alternativa (C):}$ $\color{#3368b8}{\text{Correta}}$
Certamente, devido $A$ ser um ânodo.
$• \ \text{Alternativa (D):}$ $\color{#3368b8}{\text{Correta}}$
Visto que $B$ na célula $\text{I}$ é um cátodo, seus íons em solução irão reduzir, diminuindo assim a concentração dos mesmos.
$• \ \text{Alternativa (E):}$ $\color{orangered}{\text{Errada}}$
Como visto anteriormente, será um ânodo.\begin{matrix}Letra \ (E)
\end{matrix}

