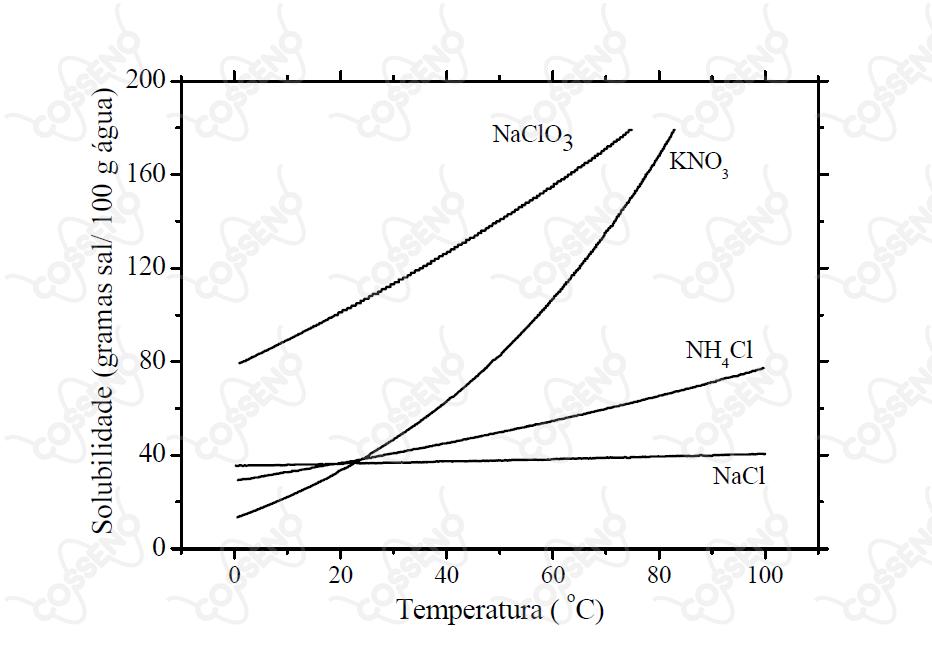
Considere um calorímetro adiabático e isotérmico, em que a temperatura é mantida rigorosamente constante e igual a . No interior deste calorímetro é posicionado um frasco de reação cujas paredes permitem a completa e imediata troca de calor. O frasco de reação contém de água pura a . Realizam-se cinco experimentos, adicionando uma massa m1 de um sal ao frasco de reação. Após o estabelecimento do equilíbrio termodinâmico, adiciona-se ao mesmo frasco uma massa de um sal e mede-se a variação de entalpia de dissolução (). Utilizando estas informações e as curvas de solubilidade apresentadas na figura, excluindo quaisquer condições de metaestabilidade, assinale a opção que apresenta a correlação CORRETA entre as condições em que cada experimento foi realizado e o respectivo .
CossenoGPT


