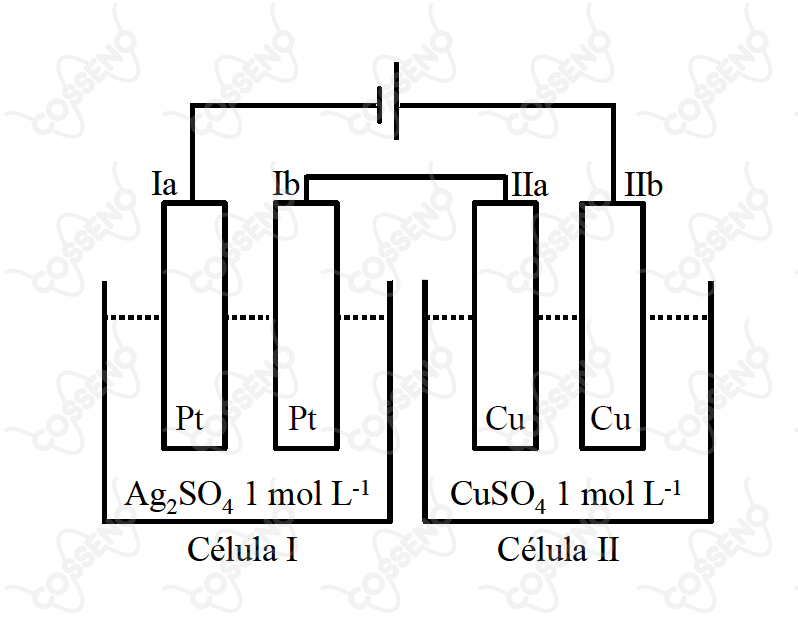
Duas células (I e II) são montadas como mostrado na figura. A célula I contém uma solução aquosa em sulfato de prata e duas placas de platina. A célula II contém uma solução aquosa em sulfato de cobre e duas placas de cobre. Uma bateria fornece uma diferença de potencial elétrico de entre os eletrodos Ia e IIb, por um certo intervalo de tempo. Assinale a opção que contém a afirmativa ERRADA em relação ao sistema descrito.
CossenoGPT
Teste
gratuitamente agora
mesmo! 

Vamos analisar o circuito, a priori, comecemos pela bateria, devido o desenho, convencionalmente temos a corrente indo de $\text{Ia}$ para $\text{IIb}$, logo, os elétrons saem de $\text{IIb}$ para $\text{Ia}$. Nesse sentido, $\text{IIb}$ é um ânodo - onde ocorre oxidação - enquanto $\text{Ia}$ é um cátodo - onde ocorre redução. A fim de manter o processo ocorrendo, necessitamos manter a corrente iônica, para isso, $\text{IIa}$ deve ser um cátodo, isto é, reduz o excesso de íons no copo da direita, assim como $\text{Ib}$ é um ânodo, transferindo íons para o copo da esquerda. Nesse sentido, vamos esquematizar como:\begin{matrix}
\text{Ia}: & \text{Cátodo} \\
\text{Ib}: & \text{Ânodo} \\
\text{IIa}: & \text{Cátodo} \\
\text{IIb}: & \text{Ânodo} \\
\end{matrix}Com isso, analisando as alternativas:
$• \ \text{Alternativa (A):}$ $\color{#3368b8}{\text{Correta}}$
No eletrodo $\text{Ib}$ ocorre oxidação, visto que ele é um ânodo. Desse modo, analisando os íons em solução, assim como o eletrodo, nota-se que o mais viável é oxidação da água, tal que:\begin{matrix}
\ce{H_2O_{(l)} &<=>&2H+_{(aq)} + O_2_{(g)} + 2e-}
\end{matrix}$\color{orangered}{\text{Obs:}}$ Não se espera a oxidação da prata, pois ela apresenta elevado potencial de redução - assim como todos os metais nobres. Analogamente, não se deve esperar a oxidação do eletrodo de platina - outro metal nobre.
$• \ \text{Alternativa (B):}$ $\color{#3368b8}{\text{Correta}}$
Certamente, visto que nele ocorre redução, assim como a prata apresenta alto potencial de redução.
$• \ \text{Alternativa (C):}$ $\color{orangered}{\text{Errada}}$
Com certeza não, visto que eles devem reduzir.
$• \ \text{Alternativa (D):}$ $\color{#3368b8}{\text{Correta}}$
Sim, o eletrodo em questão é um cátodo, assim como se espera a redução dos íons cobre em solução.
$• \ \text{Alternativa (E):}$ $\color{#3368b8}{\text{Correta}}$
Analise o copo da direita, nele se espera a oxidação do cobre em $\text{IIb}$, assim como a redução dos íons cobre em $\text{IIa}$. Portanto, idealmente, os íons que são consumidos na redução são produzidos na oxidação e vice-versa - visto que as semirreações são apenas invertidas.\begin{matrix}
\text{Redução:} & \ce{Cu^{2+} + 2e- &<=>&Cu} \\
\text{Oxidação:} & \ce{Cu &<=>&Cu^{2+} + 2e- }
\end{matrix}\begin{matrix}Letra \ (C)
\end{matrix}

