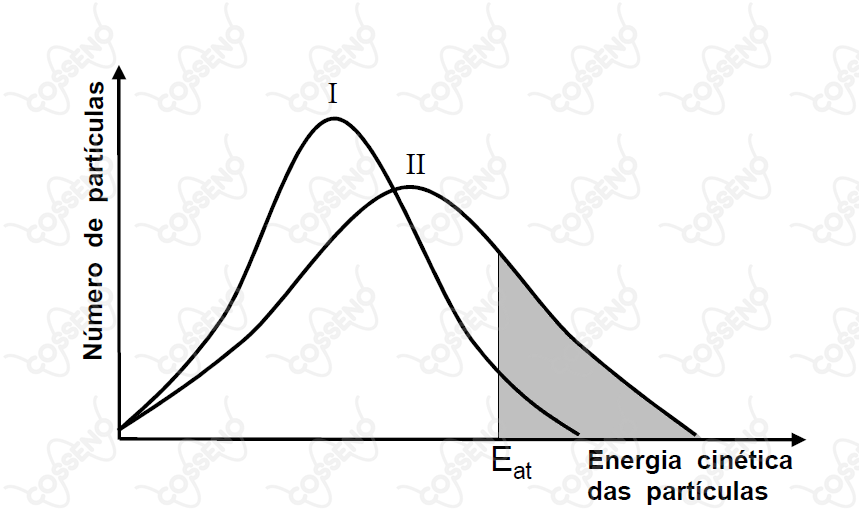
A figura ao lado representa o resultado de dois experimentos diferentes (I) e (II) realizados para uma mesma reação química genérica (reagentes produtos). As áreas hachuradas sob as curvas representam o número de partículas reagentes com energia cinética igual ou maior que a energia de ativação da reação (Eat). Baseado nas informações apresentadas nesta figura, é CORRETO afirmar que
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A questão trata da $\text{distribuição de Maxwell Boltzmann}$, esta que nos explica o porquê toda reação aumenta sua velocidade com a temperatura. Nesse viés, deve-se entender que, conforme se aquece uma substância, o número de partículas rápidas aumenta, consequentemente, menor será o número de partículas lentas. Com isso, uma substância a baixas temperaturas é de se esperar que apresente um alto número de partículas lentas, ou seja, um alto número de partículas com energia cinética baixa, como ocorre na curva $\text{I}$.
Por outro lado, a elevadas temperaturas se deve apresentar um maior número de partículas rápidas. Nesse caso, ao menos se espera que seu número de partículas lentas seja menor, isto é, dado um ponto de baixa energia cinética das partículas, espera-se ter um menor número de partículas do que numa temperatura mais baixa. Analogamente, dado um ponto de alta energia cinética das partículas, espera-se ter um maior número de partículas que numa temperatura mais baixa.
Portanto, não é difícil se inferir que a temperatura do experimento $\text{I}$ é menor que a temperatura do experimento $\text{II}$.
\begin{matrix} Letra \ (C)
\end{matrix}

