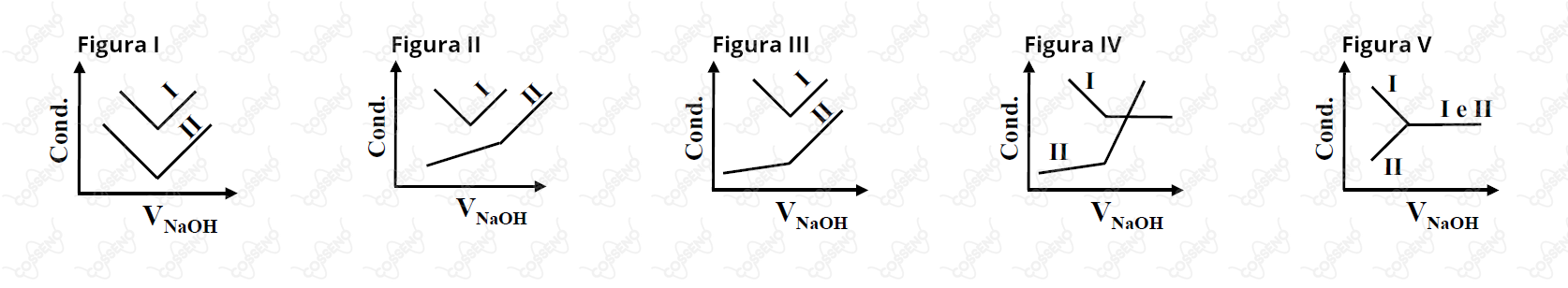
Duas soluções aquosas (I e II) contêm, respectivamente, quantidades iguais (em mol) e desconhecidas de um ácido forte, , e de um ácido fraco, = constante de dissociação do ácido. Na temperatura constante de , essas soluções são tituladas com uma solução aquosa de . A titulação é acompanhada pela medição das respectivas condutâncias elétricas das soluções resultantes. Qual das opções abaixo contém a figura com o par de curvas que melhor representa a variação da condutância elétrica (Cond.) com o volume de adicionado às soluções I e II, respectivamente?
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A questão avalia qualitativamente o conhecimento geral de equilíbrio químico. No caso, existem algumas formas de avaliar a situação, mas dado os gráficos, uma saída seria:
$\text{• Proposição I:}$ O ácido $\text{I}$ é forte, ou seja, inicialmente, apresentará alta condutibilidade, visto que irá se dissociar próximo do $100\%$. Por outro lado, o ácido $\text{II}$ é fraco, consequentemente, não promoverá íons suficientes para uma boa condutibilidade - isto é, estará bem abaixo do ácido forte. Como resultado, ao observar os gráficos, nota-se que a $\text{Figura I}$ é inviável, pois parte do pressuposto que $\text{II}$ apresentará alta condutibilidade.–
$\text{• Proposição II:}$ Ao início da titulação, a base irá consumir os hidrônios depositando cátions sódio. Para o ácido forte, haverá consumo de $\ce{H+}$ até o equilíbrio, o que promoverá uma queda da condutibilidade, em razão do cátion sódio ter menos mobilidade que os hidrônios - pense na inércia, um é mais pesado que o outro. No entanto, para o ácido fraco, a condutibilidade deve aumentar conforme a titulação, dado que a quantidade ínfima de hidrônios é quase desprezível em relação a base forte titulada. Com isso em mente, o mais importante é perceber que após o equilíbrio do ácido forte, ou o decorrer do ácido fraco, a condutibilidade deve aumentar. Portanto, nota-se que a $\text{Figura IV}$ e a $\text{Figura V}$ são inviáveis.
$\text{• Proposição III:}$ Resta-nos dois gráficos para análise, e a diferença entre eles se encontra na ideia anterior; neutralização. Observe que dado no ponto de inflexão tem-se a neutralização da solução. Nesse contexto, a inflexão da solução $\text{II}$ não pode estar à frente da solução $\text{I}$, pois neutralizar a solução $\text{II}$ requer menor quantidade de hidroxilas, ou seja, menor volume do titulante. Por isso, a $\text{Figura II}$ é inviável, restando apenas uma opção possível.\begin{matrix}Letra \ (C)
\end{matrix}

