Uma certa massa de gás ideal realiza o ciclo de transformações, como mostrado no diagrama pressão-volume da figura.
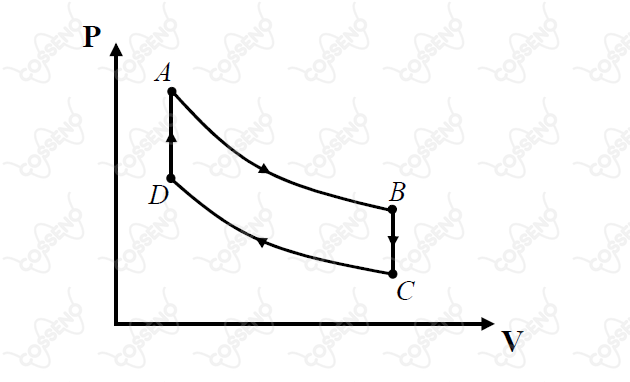
As curvas e são isotermas. Pode-se afirmar que
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{orangered}{\text{Incorreta}}$
O ciclo de Carnot é composto por duas isotermas e duas adiabáticas. Com isso, nota-se que nosso ciclo em questão não é de Carnot, mesmo que contenha as duas isotermas, no lugar das adiabáticas temos duas isocóricas.
$• \ \text{Alternativa (B):}$ $\color{orangered}{\text{Incorreta}}$
Com conhecimento dos Diagramas de Clapeyron, nota-se o sentido horário do sistema, ou seja, o sistema realiza trabalho. Nesse sentido, o gás converte calor em trabalho. Além disso, você pode olhar para as transformações $AB$ e $CD$, pelas áreas logo abaixo das curvas, sabemos que $W_{AB} > W_{CD}$.
$• \ \text{Alternativa (C):}$ $\color{orangered}{\text{Incorreta}}$
Na transformação $AB$ o volume aumenta, então, o sistema realiza trabalho, logo, o gás cede calor. Por outro lado, na transformação $CD$ o volume diminui, isto é, realiza-se trabalho sobre o sistema, ou seja, o gás recebe calor.
$• \ \text{Alternativa (D):}$ $\color{orangered}{\text{Incorreta}}$
A transformação $AB$ é isotérmica, logo, a variação de energia interna é nula. Contudo, na transformação $BC$ a variação é negativa, visto que o sistema sai de uma temperatura maior para uma menor.
$• \ \text{Alternativa (E):}$ $\color{#3368b8}{\text{Correta}}$
A tranformação $DA$ é isocórica, ou seja, não realiza trabalho. Desse modo, a variação de calor equivale a variação de energia interna, como esta última é positiva - visto que o sistema aumenta sua temperatura - o calor é recebido.\begin{matrix}Letra \ (E)
\end{matrix}

