Considere as seguintes afirmações relativas ao gráfico apresentado ao lado:
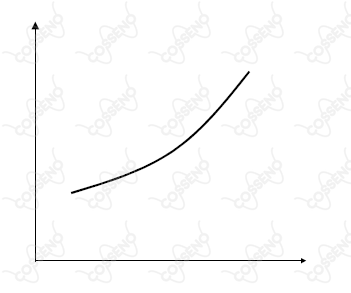
I. Se a ordenada representar a constante de equilíbrio de uma reação química exotérmica e a abscissa, a temperatura, o gráfico pode representar um trecho da curva relativa ao efeito da temperatura sobre a constante de equilíbrio dessa reação.
II. Se a ordenada representar a massa de um catalisador existente em um sistema reagente e a abscissa, o tempo, o gráfico pode representar um trecho relativo à variação da massa do catalisador em função do tempo de uma reação.
III. Se a ordenada representar a concentração de um sal em solução aquosa e a abscissa, a temperatura, o gráfico pode representar um trecho da curva de solubilidade deste sal em água.
IV. Se a ordenada representar a pressão de vapor de um equilíbrio líquido gás e a abscissa, a temperatura, o gráfico pode representar um trecho da curva de pressão de vapor deste líquido.
V. Se a ordenada representar a concentração de existente dentro de um cilindro provido de um pistão móvel, sem atrito, onde se estabeleceu o equilíbrio , e a abscissa, a pressão externa exercida sobre o pistão, o gráfico pode representar um trecho da curva relativa à variação da concentração de em função da pressão externa exercida sobre o pistão, à temperatura constante.
Destas afirmações, estão CORRETAS
CossenoGPT


20:15 20/06/2023

13:52 20/06/2023
