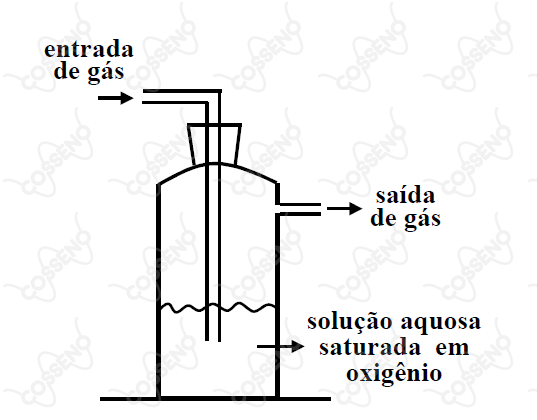
O frasco mostrado na figura ao lado contém uma solução aquosa saturada em oxigênio, em contato com ar atmosférico, sob pressão de e temperatura de . Quando gás é borbulhado através desta solução, sendo a pressão de entrada do gás maior do que a pressão de saída, de tal forma que a pressão do gás em contato com a solução possa ser considerada constante e igual a , é ERRADO afirmar que a concentração de oxigênio dissolvido na solução
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{#3368b8}{\text{Correta}}$
Como a solução é areada e saturada, ao injetar ar ela tende a expeli-lo a fim de reestabelecer o sistema - vide Le Chatelier. Com isso, não deve haver alteração na concentração dos gases presentes, já que o processo será feito de forma equivalente: todos aumentam e todos diminuem ao ponto de se reestabelecerem. Paralelamente, lembre-se que a solução está saturada e a pressão de vapor dos componentes presentes é fixa numa mesma temperatura, ou seja, ao aumentarmos a quantidade de ar presente, este deve ser expelido numa taxa maior, enquanto a taxa de introdução se mantém a mesma. Portanto, a partir desta diferença de taxas, com o passar do tempo a quantidade com que o ar é expelido diminui, até o ponto de reestabelecer o sistema.
$• \ \text{Alternativa (B):}$ $\color{orangered}{\text{Errada}}$
Conforme o nitrogênio é colocado, o sistema tende a remover a pressão acrescida - vide Le Chatelier - logo, os gases presentes começam a ser expelidos da solução. Desse modo, a concentração de oxigênio - assim como as dos demais gases presentes - deve diminuir, até o ponto de restar apenas o nitrogênio (dependendo do processo).
$• \ \text{Alternativa (C):}$ $\color{#3368b8}{\text{Correta}}$
Ao diminuirmos a temperatura, a pressão de vapor diminui, ou seja, a energia cinética das moléculas diminui, dificultando o escape, condensando mais ar do que antes, e assim aumentando a concentração de ar presente. Nesse sentido, você também poderia pensar na Lei de Henry, visto que ao diminuirmos a temperatura, sua constante decresce, logo, a concentração aumenta.
$• \ \text{Alternativa (D):}$ $\color{#3368b8}{\text{Correta}}$
Certamente, visto que em um raciocínio análogo ao da letra (B), restará tão somente oxigênio ao final, aumentando sua concentração.
$• \ \text{Alternativa (E):}$ $\color{#3368b8}{\text{Correta}}$
Analogamente ao que discutimos na alternativa (A), a concentração de oxigênio ficará a mesma, contudo, as dos demais irá diminuir, sendo-os assim substituídos pelo argônio. \begin{matrix}Letra \ (B)
\end{matrix}


