Assinale a opção que contém a geometria molecular CORRETA das espécies , , , , e , todas no estado gasoso.
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A teoria de VSEPR é mais que suficiente para descrever a geometria das espécies citadas, vejamos cada uma:
$• \ \ce{OF_2: }$ $\color{#3368b8}{\text{Angular}}$
Observe que a molécula apresenta número estérico igual a $4$, apresentando dois pares solitários, o que infere uma geometria angular como abaixo:
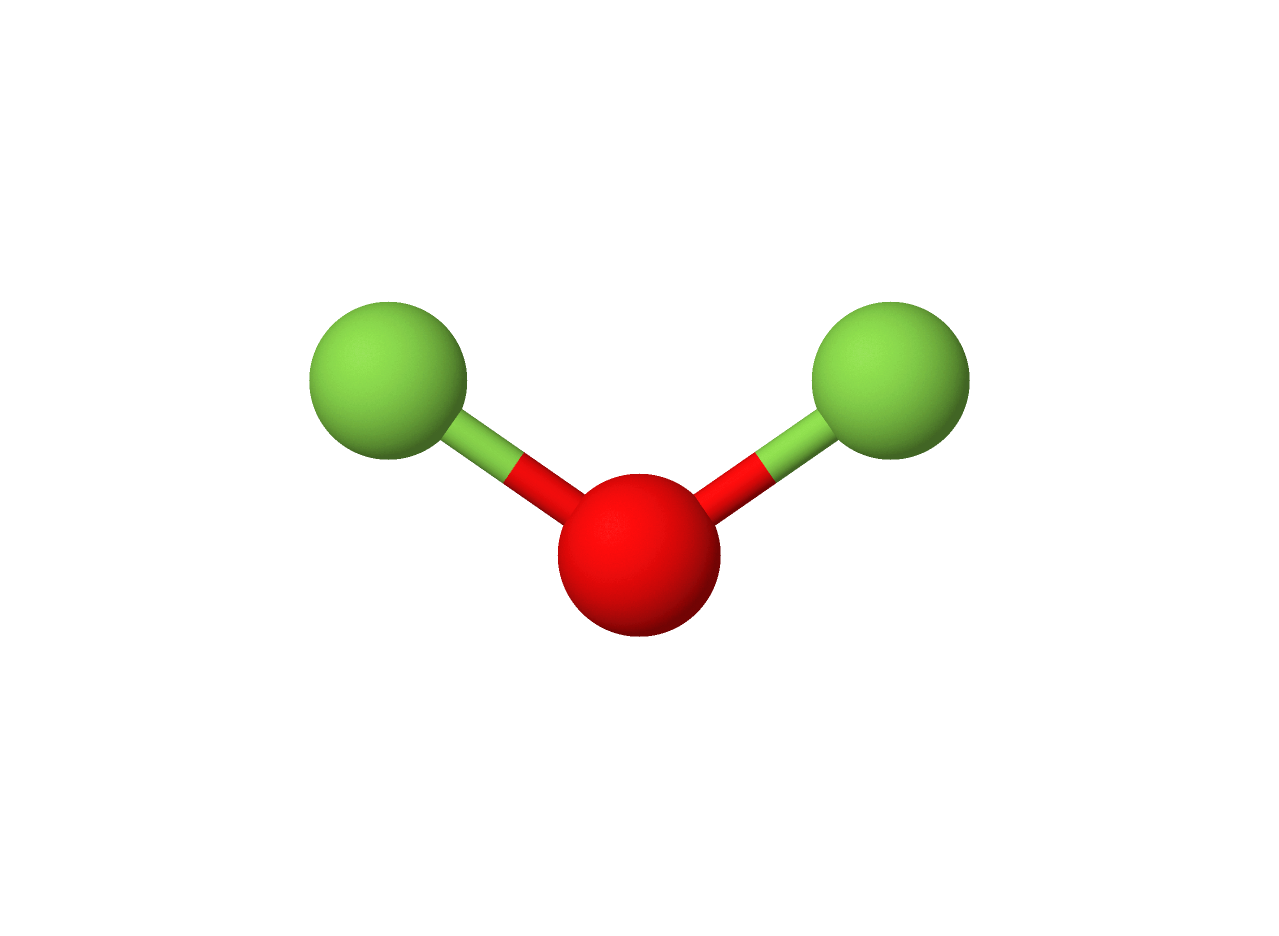 Repare que os dois pares solitários são responsáveis pela angulação da molécula, pois existe repulsão eletrônica entre os pares, deformando uma possível geometria linear.
$• \ \ce{SF_2: }$ $\color{#3368b8}{\text{Angular}}$
A situação é análoga à anterior, porém, o átomo de enxofre apresenta uma região extranuclear maior que o oxigênio. Com isso, a distância entre os pares eletrônicos é maior, o que contribui para menor repulsão do mesmo, inferindo um ângulo de ligação maior que o anterior.
Repare que os dois pares solitários são responsáveis pela angulação da molécula, pois existe repulsão eletrônica entre os pares, deformando uma possível geometria linear.
$• \ \ce{SF_2: }$ $\color{#3368b8}{\text{Angular}}$
A situação é análoga à anterior, porém, o átomo de enxofre apresenta uma região extranuclear maior que o oxigênio. Com isso, a distância entre os pares eletrônicos é maior, o que contribui para menor repulsão do mesmo, inferindo um ângulo de ligação maior que o anterior.
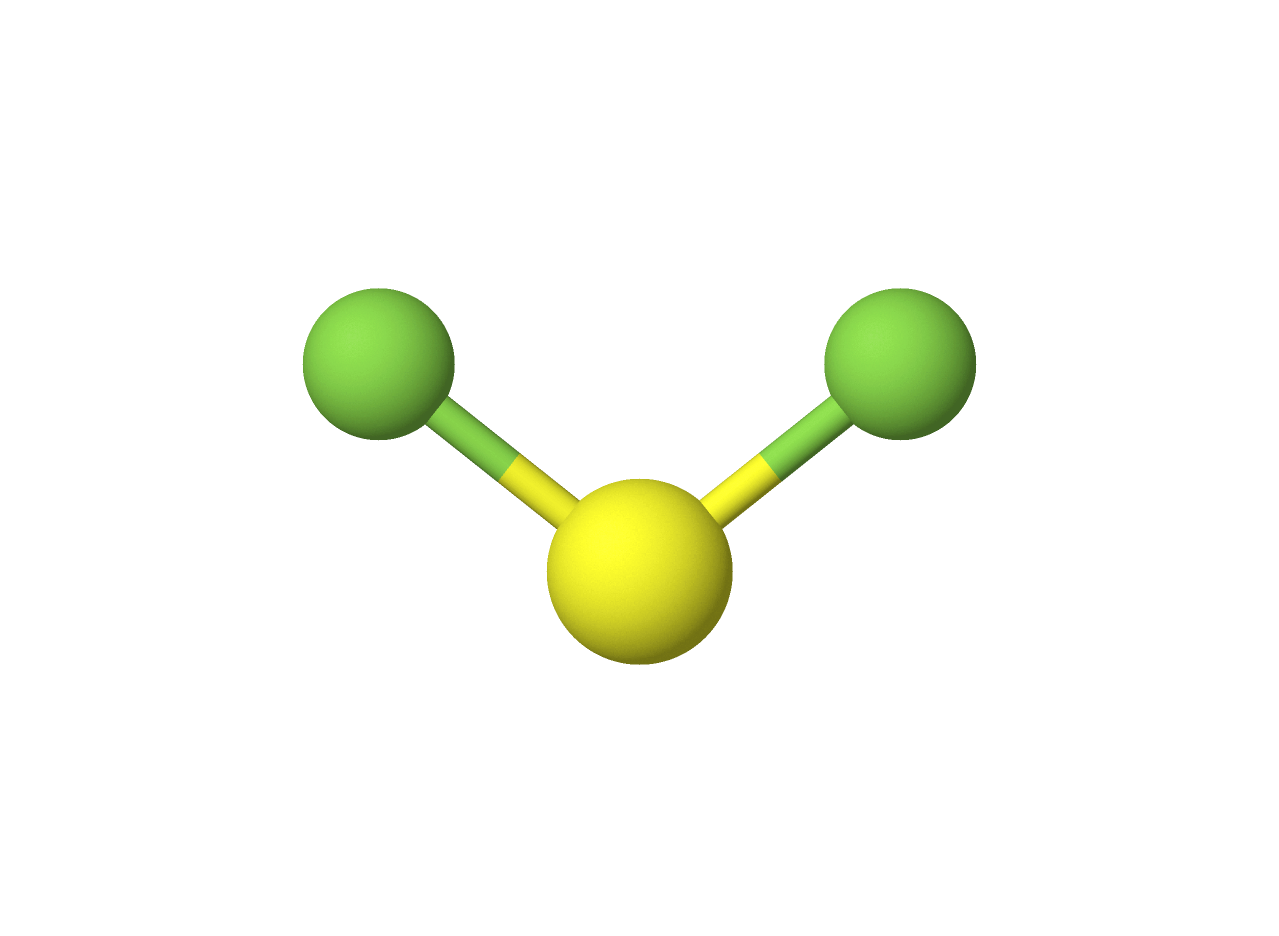 $• \ \ce{BF_3: }$ $\color{#3368b8}{\text{Trigonal Plana}}$
A molécula apresenta número estérico $3$, sem haver pares solitários:
$• \ \ce{BF_3: }$ $\color{#3368b8}{\text{Trigonal Plana}}$
A molécula apresenta número estérico $3$, sem haver pares solitários:
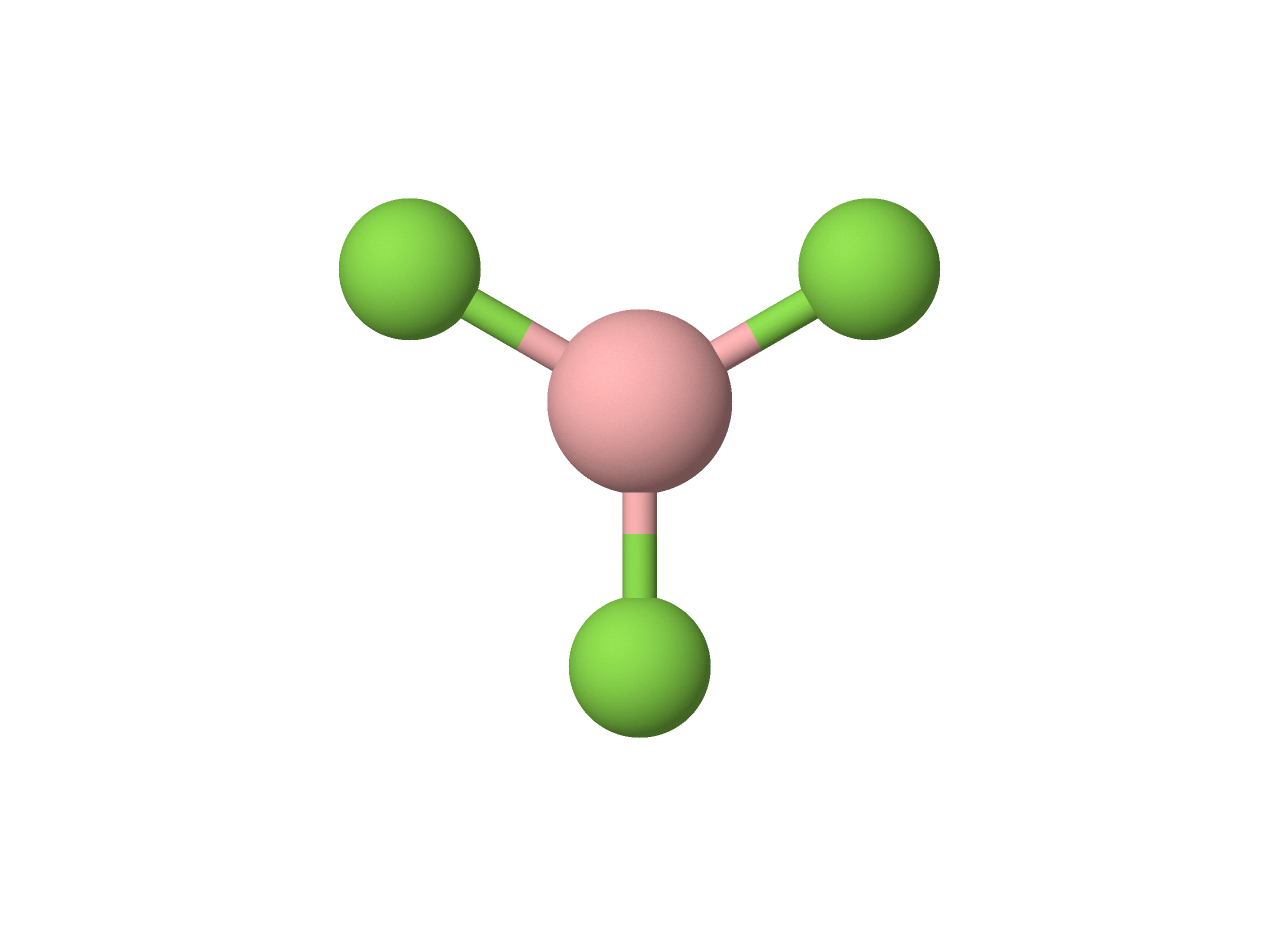 $• \ \ce{NF_3: }$ $\color{#3368b8}{\text{Piramidal Trigonal}}$
A molécula apresenta número estérico $4$, em que há um par solitário, deformando uma possível geometria tetraédrica, resultado da repulsão do par isolado com os compartilhados. Com isso, constata-se a geometria piramidal abaixo:
$• \ \ce{NF_3: }$ $\color{#3368b8}{\text{Piramidal Trigonal}}$
A molécula apresenta número estérico $4$, em que há um par solitário, deformando uma possível geometria tetraédrica, resultado da repulsão do par isolado com os compartilhados. Com isso, constata-se a geometria piramidal abaixo:
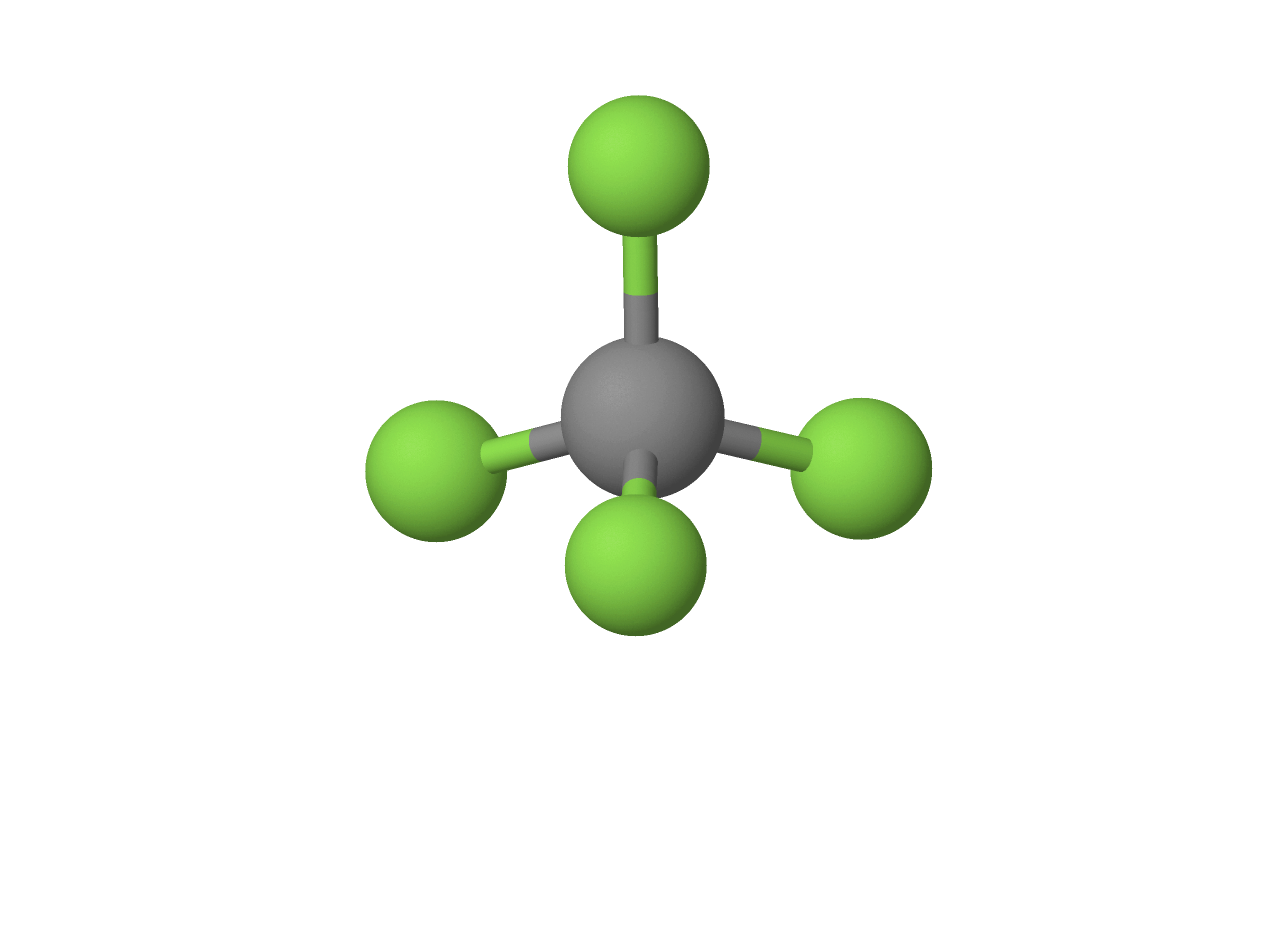
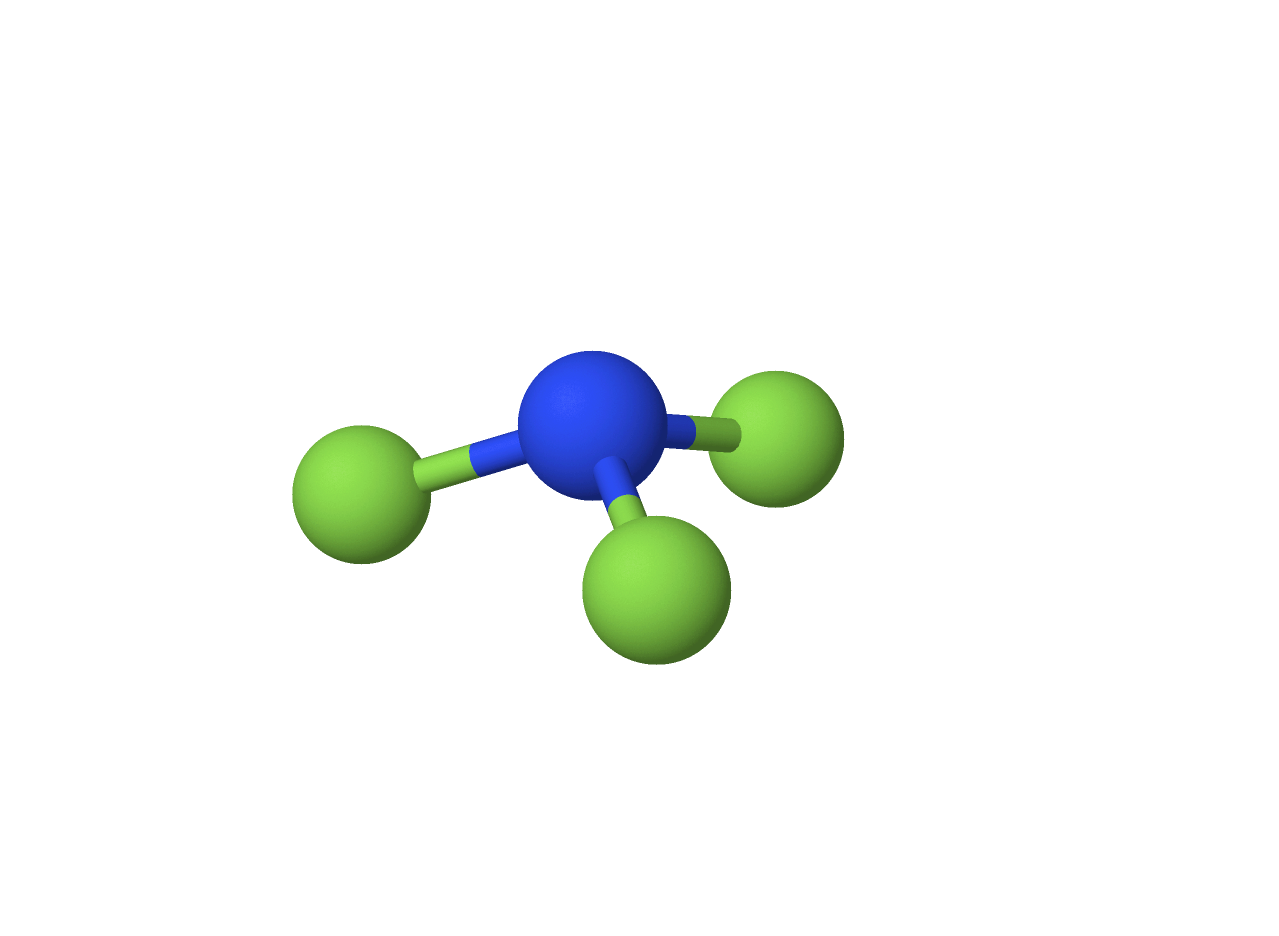 $• \ \ce{CF_4: }$ $\color{#3368b8}{\text{Tetraédrica}}$
A molécula apresenta número estérico $4$, sem haver pares solitários, configurando uma geometria tetraédrica:
$• \ \ce{CF_4: }$ $\color{#3368b8}{\text{Tetraédrica}}$
A molécula apresenta número estérico $4$, sem haver pares solitários, configurando uma geometria tetraédrica:
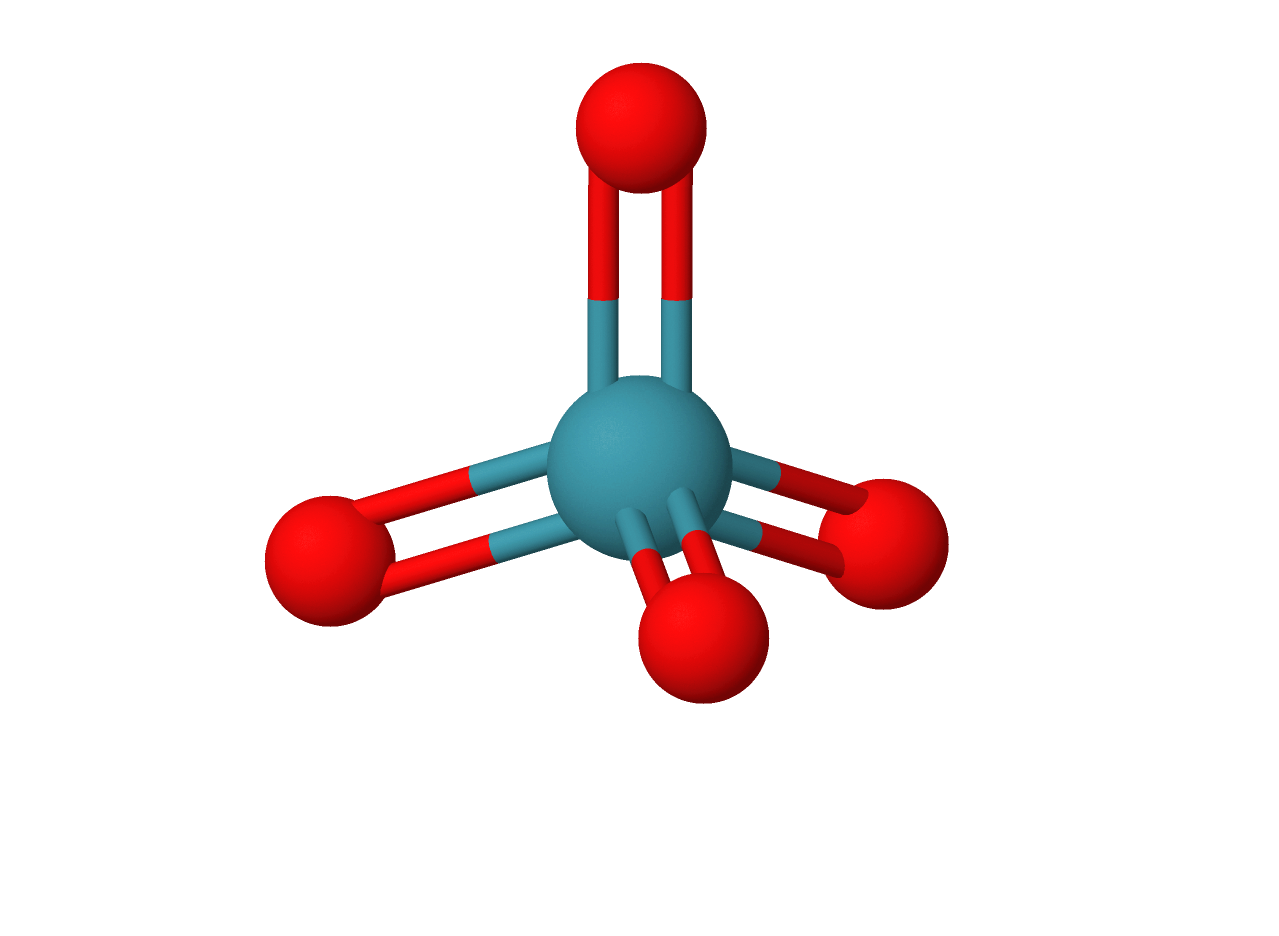
 $• \ \ce{XeO_4: }$ $\color{#3368b8}{\text{Tetraédrica}}$
A molécula apresenta número estérico $4$, com quatro ligações duplas, sem haver pares solitários, configurando também uma geometria tetraédrica:
$• \ \ce{XeO_4: }$ $\color{#3368b8}{\text{Tetraédrica}}$
A molécula apresenta número estérico $4$, com quatro ligações duplas, sem haver pares solitários, configurando também uma geometria tetraédrica:
 \begin{matrix}Letra \ (C)
\end{matrix}
\begin{matrix}Letra \ (C)
\end{matrix}

Ampliar Imagem

Ampliar Imagem

Ampliar Imagem

Ampliar Imagem

Ampliar Imagem

Ampliar Imagem

