A figura abaixo mostra a curva de solubilidade do brometo de potássio () em água: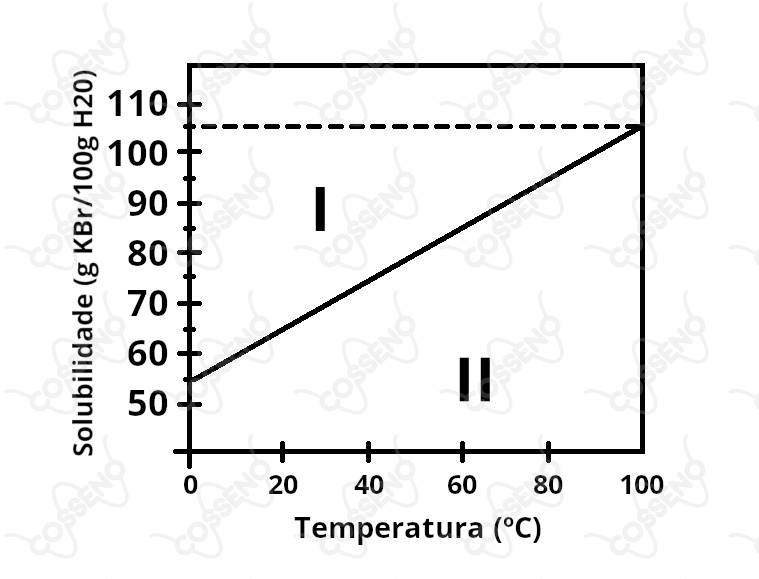
Baseado nas informações apresentadas nesta figura é ERRADO afirmar que:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{royalblue}{\text{Correta}}$
A inclinação positiva da reta caracteriza uma entalpia de solução $(\Delta H_{solução})$ positiva, ou seja, essa dissolução é um processo endotérmico, pois é favorecido ao aumento da temperatura (Le Chatelier).
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Correta}}$
Com uma régua, ou um olhar mais cuidadoso, é possível perceber que nesse ponto a solubilidade é próxima de $70:100$, nessa perspectiva, temos: \begin{matrix} C &=& {{\dfrac{\ce{1 \ mol \ KBr}}{\ce{120g \ KBr}}}} \cdot {{\dfrac{\ce{70 g \ KBr}}{\ce{100 g \ H_2O}}}} \cdot {{\dfrac{\ce{1000 g \ H_2O}}{\ce{1 \ kg \ H_2O}}}} &\approx& 6 \ \pu{mol/kg}
\end{matrix}
$• \ \text{Alternativa (C):}$ $\color{orangered}{\text{Incorreta}}$
Na região $I$ acima da reta, encontram-se misturas supersaturadas (monofásicas) e saturadas com corpo de fundo (bifásicas). Nesse contexto, realmente existem misturas bifásicas, numa fase o precipitado e outra a solução, todavia, também é possível encontrar pontos de supersaturação, pontos metaestáveis, mas monofásicos.
$• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Correta}}$
Abaixo da reta teremos soluções diluídas, caracterizando uma fase, no caso, a solução.
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Sobre a linha estarão os pontos de saturação, ou seja, a quantidade máxima de soluto que se pode dissolver num determinado volume e temperatura, isso claro, descartando a supersaturação.
\begin{matrix} Letra \ (C)
\end{matrix}

