Certa substância foi aquecida em um recipiente aberto, em contato com o ar, numa velocidade de . A figura abaixo mostra, em termos percentuais, como varia a fração de massa residual remanescente no recipiente em função da temperatura.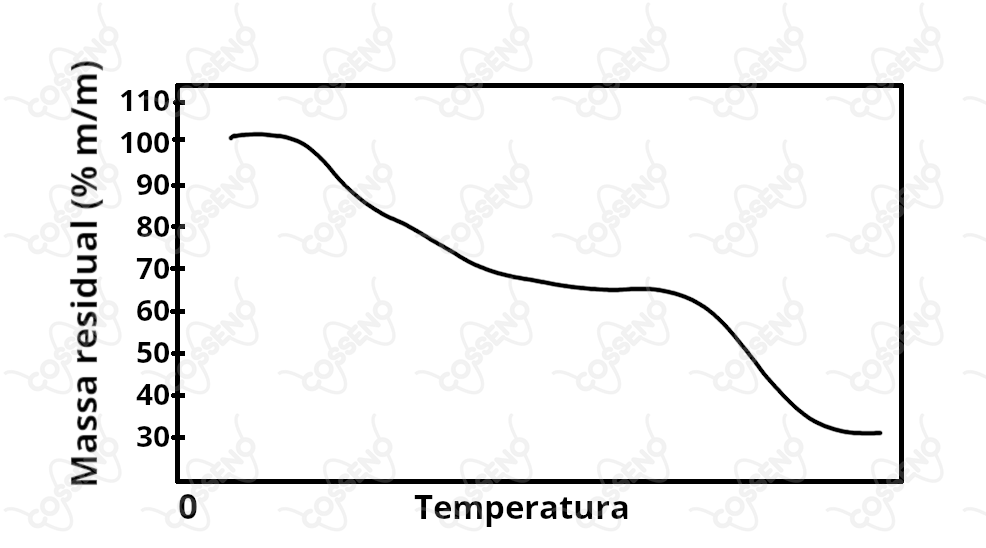
Qual das opções abaixo apresenta a substância, no estado sólido, que poderia apresentar tal comportamento?
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A questão é mais simples do que aparenta, a princípio, deve-se analisar o gráfico e reparar nas duas declinações, estas que nos permite inferir haver três estágios durante o processo. Além disso, observe que existe uma boa quantidade de resíduo termodinamicamente estável ao final, nesse sentido, vamos analisar cada alternativa:
$• \ \text{Alternativa (A):}$ $\color{orangered}{\text{Incorreta}}$
Pensando no aquecimento do carbonato de cálcio, este que a certa temperatura deve se decompor como:\begin{matrix}
\ce{CaCO_3_{(s)} &->& CaO_{(s)} + CO_2_{(g)} + H_2O_{(l)}}
\end{matrix}O processo é plausível, nos restando $\ce{ CaO_{(s)}}$, porém, pelo gráfico, outro processo deve ocorrer, mas qual? Provavelmente, nenhum e, é aqui que encontramos a incoerência da alternativa, visto que o óxido de cálcio apresenta ponto de fusão e (certamente) decomposição muito elevados. Com isso, pensando no "aquecendo $\ce{10/min °C}$" e analisando as proporções do gráfico, o último declive deveria ser extremamente extenso, o que claramente não é.
$• \ \text{Alternativa (B):}$ $\color{#3368b8}{\text{Correta}}$
Analogamente, vamos pensar no aquecimento do bicarbonato de cálcio, em que:\begin{matrix}
\ce{Ca(HCO_3)_2_{(s)} &->& CaCO_3_{(s)} + CO_2_{(g)} + H_2O_{(l)}}
\end{matrix}Pondere que não deve ser necessário um aquecimento tão elevado para tal, o que corrobora com o gráfico. Adiante, pensando no segundo processo, podemos descrever a decomposição do carbonato de cálcio como na alternativa anterior. Dessa forma, restaria o óxido de cálcio que, com sua alta resistência ao calor, comportar-se-ia como um resíduo termodinamicamente estável - semelhante ao gráfico.
$• \ \text{Alternativas (C e E):}$ $\color{orangered}{\text{Incorretas}}$
É inusitado pensar que estes compostos apresentariam mais de um estágio, pois sua decomposição resultaria em gases. Além disso, por se resultar em gases, não se espera resíduo.
$• \ \text{Alternativa (D):}$ $\color{orangered}{\text{Incorreta}}$
Inicialmente, podemos escrever:\begin{matrix}
\ce{CaSO_4_{(s)} &->& CaO_{(s)} + SO_2_{(g)} + \dfrac{1}{2}O_2_{(g)}}
\end{matrix}Num raciocínio completamente análogo ao da alternativa $(A)$, pode-se dizer que este não pode ser o composto em análise.\begin{matrix}Letra \ (B)
\end{matrix}

