Entre as afirmações abaixo, assinale a opção ERRADA:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$\cdot\ Alternativa\ A:\ \color{green}{Correta}:$
De fato, hidrogenoides são, por definição elementos, que possuem apenas um elétron, diferindo entre si apenas na carga nuclear (nêutrons e prótons). Logo os exemplos são hidrogenoides, pois o Lítio normalmente teria $3$ elétrons está com carga $2+$, significando que perdeu $2$ elétrons, o mesmo ocorre com o Berílio e o Hélio.
$\cdot\ Alternativa\ B:\ \color{green}{Correta}:$
Sim, são chamados de orbitais degenerados justamente por possuir a mesma energia. Isso ocorre em átomos hidrogenoides, pois ele possuem apenas um elétron e, por isso, não sofre "shielding" (interação) de outros elétrons, de maneira que sua energia depende apenas da sua distância ao núcleo, ditada pelo número quântico principal (ou $n$). Dessa maneira temos em ordem crescente de energia para hidrogenoides:
$$E_{1s}<E_{2s}=E_{2p}<E_{3s}=E_{3p}=E_{3d}$$
$\cdot\ Alternativa\ C:\ \color{green}{Correta}:$
Correto. Pela explicação da última alternativa é possível concluir que átomos não hidrogenoides não possuem orbitais degenerados, isso porque há interação tanto núcleo-elétron quanto quanto elétrons-elétron, de maneira que as energias dos orbitais com mesmo número quântico principal não são as mesmas (a não ser para $n=1$).
$\cdot\ Alternativa\ D:\ \color{green}{Correta}:$
Correto. A função de probabilidade de onda que é representada pelo orbital $p$ possui um plano nodal passando pelo núcleo, de maneira que a probabilidade de encontrar um elétron nessa região é nula.
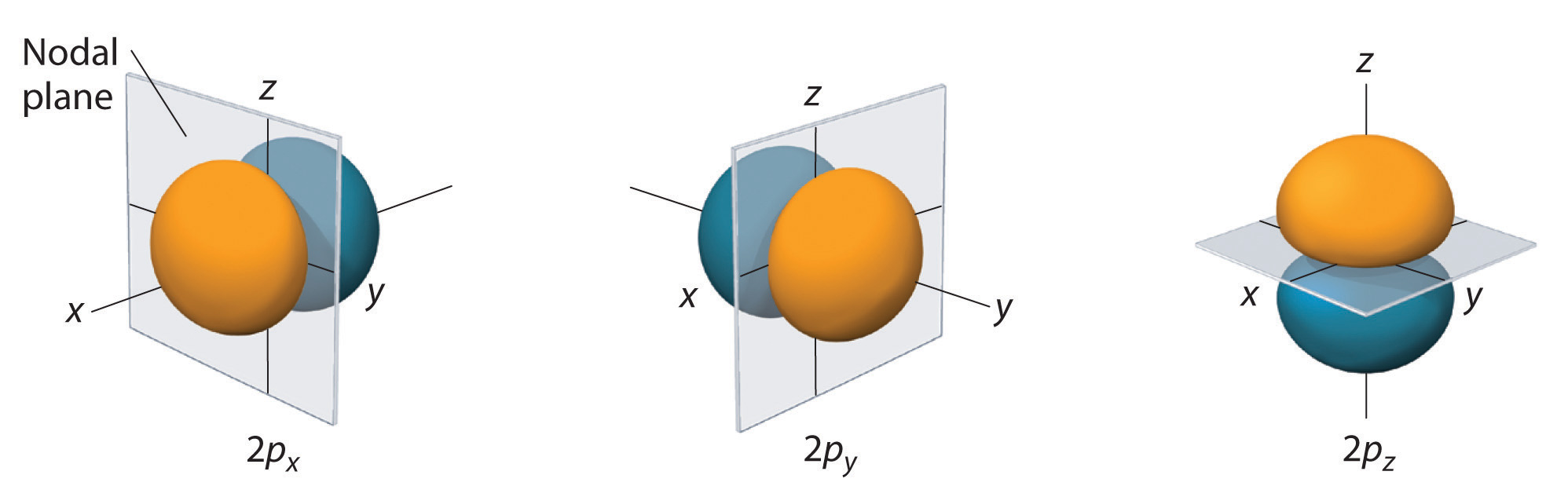 $\cdot\ Alternativa\ E:\ \color{red}{Incorreta}:$
Falso. A carga nuclear do Hélio é superior à do Hidrogênio, de maneira que a interação entre núcleo elétron é diferente (maior) e, por isso, o espectro de absorção/emissão do $\ce{He^+}$ difere do $\ce{H}$, mesmo sendo um hidrogenoide.
$$Letra\ E$$
$\cdot\ Alternativa\ E:\ \color{red}{Incorreta}:$
Falso. A carga nuclear do Hélio é superior à do Hidrogênio, de maneira que a interação entre núcleo elétron é diferente (maior) e, por isso, o espectro de absorção/emissão do $\ce{He^+}$ difere do $\ce{H}$, mesmo sendo um hidrogenoide.
$$Letra\ E$$

Ampliar Imagem


