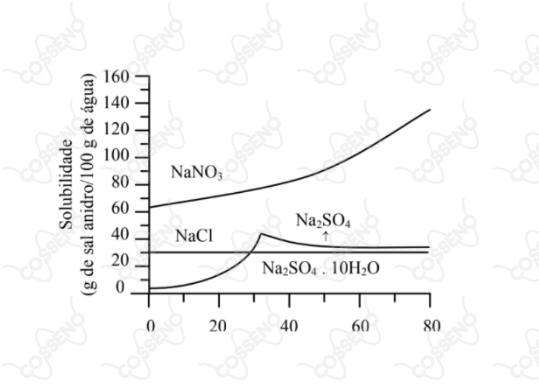
Em relação a dissolução de um mol de sal em água, a . É errado afirmar que:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A questão trata sobre $\text{Calor de Solução}$, algumas substâncias dissolvem-se com desprendimento de calor, outras com absorção. Nesse viés, deve-se conhecer o processo que ocorre em duas etapas:\begin{matrix}
\text{(1):} & \text{Desintegração do retículo cristalino - processo endotérmico - energia reticular} \\
\text{(2):} & \text{Solvatação dos íons - processo exotérmico - energia de hidratação}
\end{matrix} A soma da $\Delta H_{ret}$ mais a $\Delta H_{hid}$ nos dá o calor de solução, normalmente escrito como $\Delta H_{sol}$, mas o ITA preferiu escrever $\Delta H_{dis}$, relativo a dissolução. Nessa perspectiva, não é difícil analisar cada caso, para isso, deve-se ter conhecimento do $\text{Princípio de Le Chatelier}$, em que, processos endotérmicos são beneficiados pela acréscimo de temperatura, vide a intenção do sistema de reestabelecer o equilíbrio consumindo calor.
$• \ \text{Alternativa (A):}$ $\color{royalblue}{\text{Verdadeira}}$
Certamente, é um processo extremamente exotérmico.
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Verdadeira}}$
Como dito anteriormente, o processo de hidratação é exotérmico, além disso, ressalta-se que as curvas crescentes do gráficos representam reações endotérmicas - pois se beneficiam do acréscimo de temperatura. Desse modo, entende-se que por reações endotérmicas, temos $|\Delta H_{ret}| >| \Delta H_{hid}|$, logo, analisando o gráfico, percebe-se que o sal hidratado se beneficia do aumento da temperatura, enquanto o sal puro não.
Portanto, o calor de hidratação do sal puro é maior em módulo que o do sal hidratado, o que, sinceramente, é bem lógico, já que um já está hidratado.
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Verdadeira}}$
Certamente, como dito na alternativa anterior, o sal hidratado se beneficia do acréscimo de temperatura, seu calor de solução é positivo - dentro da convenção padrão de entalpia. Por outro lado, o sal puro não se beneficia da temperatura, muito pelo contrário, ele é prejudicado, caracteriza-se assim um processo exotérmico.
$• \ \text{Alternativa (D):}$ $\color{orangered}{\text{Falsa}}$
Nessa análise, é interessante pensar no produto de solubilidade, junto a $\text{equação de Arrhenius}$. Com isso, deve-se entender que a solubilidade é proporcional ao produto de solubilidade, e este último é inversamente proporcional a $e^{\Delta H_{diss}}$. Por estarmos avaliando módulos, estamos nos preocupando com "magnitudes", isto equivale a dizer grandes variações nas curvas do gráfico - grandes variações de soluto. Portanto, é fácil perceber que a variação do sal hidratado é bem maior que a do sal puro, consequentemente, seu módulo do calor de formação é maior.
$• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Verdadeira}}$
Vide alternativa anterior, não é difícil dizer que esta afirmativa está correta. Entretanto, vale notar que a solubilidade do cloreto de sódio independe da temperatura. Nesse contexto, é de se esperar que o calor de solução do cloreto de sódio seja próximo do zero.
\begin{matrix} Letra \ (D)
\end{matrix}

