Em relação à estrutura eletrônica do tetrafluoreto de carbono, assinale a opção que contém a afirmativa errada:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{royalblue}{\text{Correta}}$
Com conhecimento da estrutura de Lewis, não é difícil identificar que a alternativa esteja correta, veja:
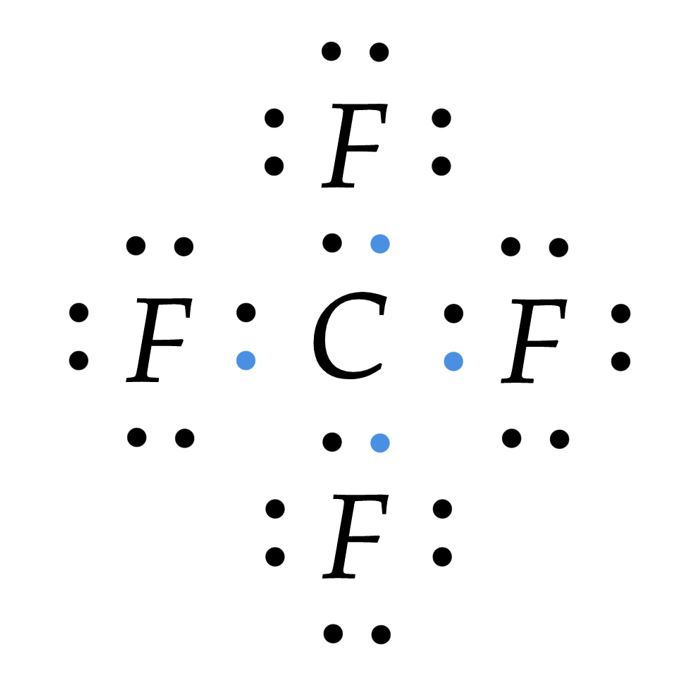 $\color{orangered}{Obs:}$ As cores são de cunho didático, não existe a diferença entre elétrons, elétrons são elétrons.
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Correta}}$
Vide alternativa anterior.
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Correta}}$
As ligações $C-F$ são covalentes polares, porém, sua geometria tetraédrica favorece um momento dipolar aproximadamente nulo, caracterizando uma molécula apolar.
$• \ \text{Alternativa (D):}$ $\color{orangered}{\text{Incorreta}}$
Com certeza não, veja que cada átomo de flúor apresenta $\text{9 elétrons}$, já o de carbono apresenta $\text{6}$, logo, temos $\text{42 elétrons}$ no total.
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Para formar as quatro ligações, o átomo de carbono precisa sofrer hibridização de seus orbitais, formando quatro orbitais $sp^3$ equivalentes. Nessa perspectiva, ao ocorrer as ligações, teremos uma molécula tetraédrica, com ângulos consistentes de $109^{\circ}28^{'}$.\begin{matrix}Letra \ (D)
\end{matrix}
$\color{orangered}{Obs:}$ As cores são de cunho didático, não existe a diferença entre elétrons, elétrons são elétrons.
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Correta}}$
Vide alternativa anterior.
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Correta}}$
As ligações $C-F$ são covalentes polares, porém, sua geometria tetraédrica favorece um momento dipolar aproximadamente nulo, caracterizando uma molécula apolar.
$• \ \text{Alternativa (D):}$ $\color{orangered}{\text{Incorreta}}$
Com certeza não, veja que cada átomo de flúor apresenta $\text{9 elétrons}$, já o de carbono apresenta $\text{6}$, logo, temos $\text{42 elétrons}$ no total.
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Para formar as quatro ligações, o átomo de carbono precisa sofrer hibridização de seus orbitais, formando quatro orbitais $sp^3$ equivalentes. Nessa perspectiva, ao ocorrer as ligações, teremos uma molécula tetraédrica, com ângulos consistentes de $109^{\circ}28^{'}$.\begin{matrix}Letra \ (D)
\end{matrix}

Ampliar Imagem

