Este teste se refere ao elemento galvânico esquematizado a seguir.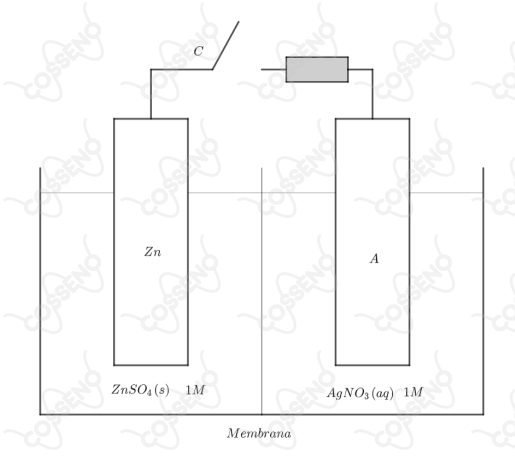
Assinale a afirmação falsa em relação ao que vai acontecer quando a chave é ligada:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

A priori, a questão nos informa que temos uma célula galvânica, logo, precisamos descobrir quem é o cátodo e quem é o ânodo, isto claro, num processo espontâneo. Nesse contexto, podemos analisar qual eletrodo tem maior tendência para se oxidar, e este certamente é o zinco, tanto por seu baixo potencial de redução (relativamente alto de oxidação), como por a prata ser um metal nobre, de caráter redutivo, isto é, não espera-se que ela forneça íons a solução. Com isso, vamos analisar cada alternativa:
$• \ \text{Alternativa (A):}$ $\color{royalblue}{\text{Verdadeira}}$
Como dito anteriormente, o eletrodo de zinco irá se oxidar, atuando como ânodo, ou seja, ele doa elétrons ao circuito externo. Nesse sentido, os elétrons vão do ânodo para o cátodo, tal qual a corrente convencional vai do cátodo para o ânodo.
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Verdadeira}}$
Os elétrons saem do ânodo para o cátodo, ou seja, sairão do eletrodo de zinco (esquerda) e irão pra o eletrodo de prata (direita).
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Verdadeira}}$
Os íons em solução devem migrar durante o processo, isto é necessário devido a necessidade de estabelecer a eletroneutralidade da solução, do contrário, o excesso de carga inviabilizaria o processo, ou seja, o cessaria. Nesse contexto, essa migração é conhecida como $\text{corrente iônica}$, em que o íons negativos migram para o ânodo - por isso chamados de ânions - tal-qualmente os íons positivos migram para o cátodo.
$• \ \text{Alternativa (D):}$ $\color{orangered}{\text{Falsa}}$
Visto o que foi discutido anteriormente, a concentração de sulfato de zinco não irá aumentar, espera-se na verdade o contrário, isto é, a sua dissociação.
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Verdadeira}}$
Visto o que foi discutido na alternativa (C).
\begin{matrix}Letra \ (D)\end{matrix}

