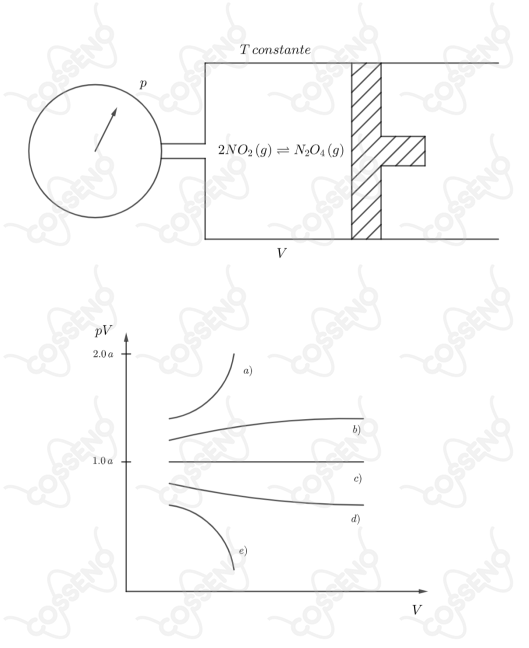
Sob temperatura constante, um cilindro provido de pistão móvel e manômetro, conforme mostrado na figura a seguir, contém uma mistura gasosa de e em equilíbrio. Para cada nova posição do pistão, esperamos o equilíbrio se restabelecer e anotamos os valores e . Feito isso, fazemos um gráfico do produto versus . Qual das curvas a seguir se próxima mais da forma que devemos esperar do gráfico em questão?
CossenoGPT
Teste
gratuitamente agora
mesmo! 

Ignorando o equilíbrio químico, isto é, considerando a quantidade de moléculas constante, o aumento do volume levaria a diminuição da pressão, fazendo o produto $pV$ ser constante. Nesse contexto, o gráfico correto seria o da letra $(c)$.
Contudo, a presença da reação química influencia nos resultados, veja que, a princípio, temos um processo de expansão do volume. Nessa expansão, a concentração de moléculas diminui, e assim o equilíbrio se descola para esquerda, a fim de repor a concentração perdida - vide Le Chatelier. Com isso, o produto $pV$ aumenta por um determinado tempo, este tempo é o período em que o equilíbrio se desloca para esquerda, até um ponto em que não haja mais reação, ou seja, momento em que todas as moléculas serão de $NO_2$.
Quando toda reação se deslocar para esquerda a fim de amenizar o efeito da contínua expansão, o produto $pV$ voltará a ter um caráter constante, pois o número de moléculas a partir daí será constante também. Portanto, analisando o gráfico, constata-se que a melhor curva para representar a situação é a $(b)$.\begin{matrix}Letra \ (B)
\end{matrix}

