Num copo contendo solução aquosa molar de são introduzidas duas chapas de prata. Uma das chapas () é ligada ao pólo positivo de uma bateria e a outra () é ligada ao pólo negativo desta bateria. Durante a eletrólise não ocorre despreendimento gasoso. Assinale a afirmação ERRADA:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

Montando a situação descrita, tem-se algo como:
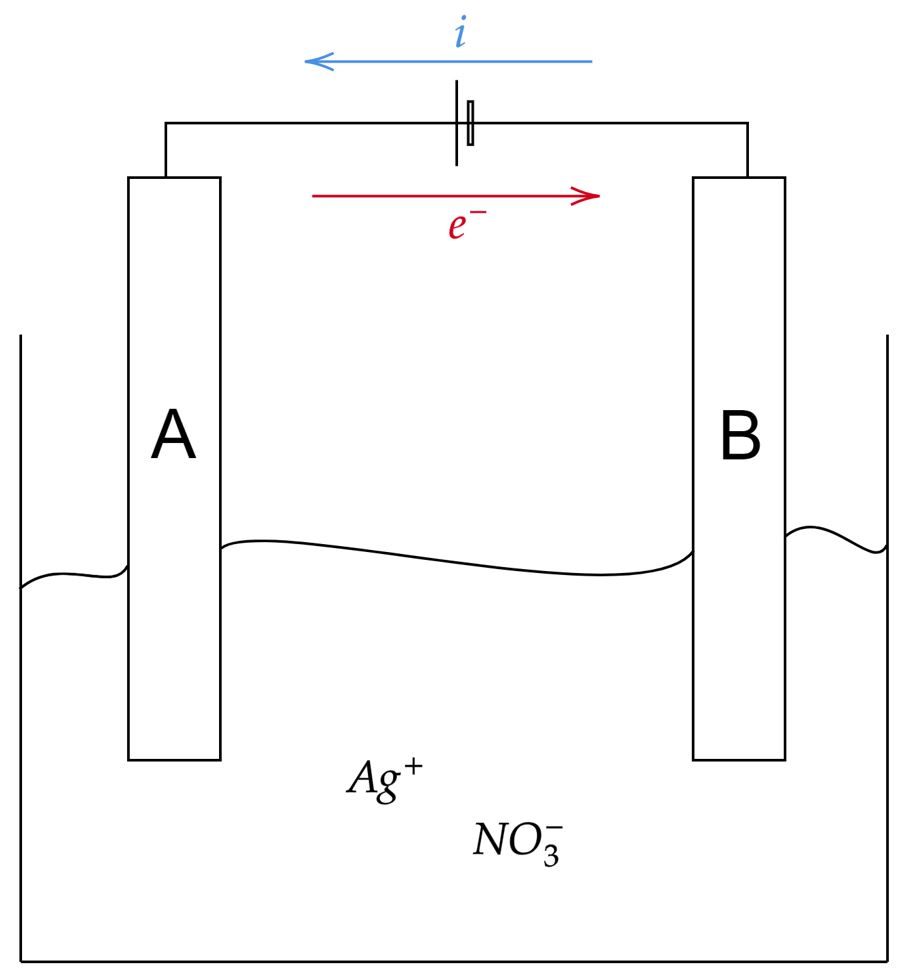 Nesta situação, nota-se que a chapa $\text{A}$ atuará como ânodo, por conseguinte, a chapa $\text{B}$ atuará como cátodo. Com isso, podemos analisar as alternativas:
$• \ \text{Alternativa (A):}$ $\color{orangered}{\text{Errada}}$
Ora, se $\text{A}$ é o ânodo, este deve se oxidar, ou seja, perder sua massa enquanto deposita íons prata (I) na solução.
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Correta}}$
No cátodo ocorre o processo de redução do íons prata (I) da solução, este processo pode ser representado como:\begin{matrix}\text{Cátodo:}&
\ce{Ag+_{(aq)} + e- \rightarrow Ag_{(c)}}
\end{matrix}
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Correta}}$
Note que, do mesmo modo que os íons prata (I) da solução se reduzem em $\text{B}$, o ânodo $\text{A}$ compensa com a oxidação do mesmo. Atente que, isto é necessário para manter a eletroneutralidade da solução, do contrário, ocorre excesso de carga e o processo cessa.
$• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Correta}}$
Os íons nitrato apresentam um papel muito importante na solução, mesmo que não participem da reação, eles dão continuidade para $\text{corrente iônica}$ - esta que permite não ocorrer o acúmulo de carga em qualquer região da fase líquida. Enfim, durante o processo de eletrólise, os íons nitrato migram no sentido do cátodo para o ânodo a fim de neutralizar a região catódica.
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Esta é, basicamente, uma das $\href{https://pt.wikipedia.org/wiki/Lei_de_Faraday_da_eletr%C3%B3lise}{\text{Leis de Faraday}}$ - clique para ver.
\begin{matrix}Letra \ (A)
\end{matrix}
Nesta situação, nota-se que a chapa $\text{A}$ atuará como ânodo, por conseguinte, a chapa $\text{B}$ atuará como cátodo. Com isso, podemos analisar as alternativas:
$• \ \text{Alternativa (A):}$ $\color{orangered}{\text{Errada}}$
Ora, se $\text{A}$ é o ânodo, este deve se oxidar, ou seja, perder sua massa enquanto deposita íons prata (I) na solução.
$• \ \text{Alternativa (B):}$ $\color{royalblue}{\text{Correta}}$
No cátodo ocorre o processo de redução do íons prata (I) da solução, este processo pode ser representado como:\begin{matrix}\text{Cátodo:}&
\ce{Ag+_{(aq)} + e- \rightarrow Ag_{(c)}}
\end{matrix}
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Correta}}$
Note que, do mesmo modo que os íons prata (I) da solução se reduzem em $\text{B}$, o ânodo $\text{A}$ compensa com a oxidação do mesmo. Atente que, isto é necessário para manter a eletroneutralidade da solução, do contrário, ocorre excesso de carga e o processo cessa.
$• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Correta}}$
Os íons nitrato apresentam um papel muito importante na solução, mesmo que não participem da reação, eles dão continuidade para $\text{corrente iônica}$ - esta que permite não ocorrer o acúmulo de carga em qualquer região da fase líquida. Enfim, durante o processo de eletrólise, os íons nitrato migram no sentido do cátodo para o ânodo a fim de neutralizar a região catódica.
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Esta é, basicamente, uma das $\href{https://pt.wikipedia.org/wiki/Lei_de_Faraday_da_eletr%C3%B3lise}{\text{Leis de Faraday}}$ - clique para ver.
\begin{matrix}Letra \ (A)
\end{matrix}

Ampliar Imagem

