Considere os compostos seguintes:
I.
II.
III.
IV.
V.
Entre as opções seguintes, qual é aquela que contém a afirmação falsa em relação a estes compostos ?
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{#3368b8}{\text{Verdadeira}}$
Reações catalisadas por ácidos de um ácido carboxílico com um álcool são chamadas de esterificações. No caso, o produto é chamado éster, formado pela secção das ligações $\ce{C-O}$ dos reagentes. Veja abaixo a reação:
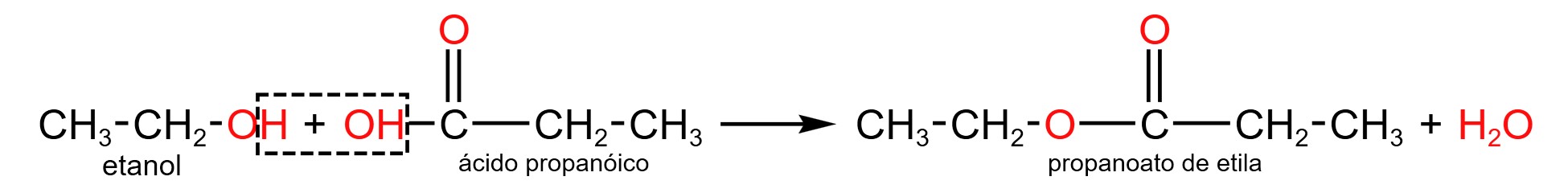 $• \ \text{Alternativa (B):}$ $\color{orangered}{\text{Falsa}}$
A propanona apresenta estrutura trigonal plana, porém, é levemente polar devido a diferença de eletronegatividade do grupo carbonila.
$• \ \text{Alternativa (C):}$ $\color{#3368b8}{\text{Verdadeira}}$
A etilamina é o composto mais básico entre os do enunciado, isto devido a amina primária presente, esta que apresenta um par eletrônico isolado no nitrogênio. Portanto, aminas reagem como bases semelhantemente à amônia, sendo assim, categoricamente básicas.
$\color{orangered}{\text{Obs:}}$ Creio que uma dúvida pode ser: por que não poderia ser a propionamida? Sucintamente, pois a eletronegatividade da carbonila desloca o par eletrônico isolado do nitrogênio para ela. Desse modo, é mais difícil doar o par isolado, justificando-se assim um menor caráter básico que as aminas.
$• \ \text{Alternativa (D):}$ $\color{#3368b8}{\text{Verdadeira}}$
Amidas apresentam um grupo carbonila ligado a um átomo de nitrogênio, como no composto (IV). Por outro lado, aminas se caracterizam por átomos de nitrogênio ligados a resíduos hidrocarbônicos, como no composto (III).
$• \ \text{Alternativa (E):}$ $\color{#3368b8}{\text{Verdadeira}}$
Ácidos carboxílicos não apresentam este nome atoa, veja que a grande diferença de acidez entre os compostos pode ser explicada por seus respectivos íons negativos (bases conjugadas). Nesse contexto, nota-se uma grande diferença de estabilidade entre o íon carboxilato e o íon alcóxido, isto devido a ressonância no íon carboxilato, esta que dissipa a carga negativa do íon, deslocalizando os elétrons de valência e contribuindo para estabilidade. Por outro lado, o íon alcóxido não apresenta ressonância, não havendo expressiva estabilidade, inclusive, muito pelo contrário.
Além disso, não se esqueça que a estabilidade da base conjugada também atribui a força de um ácido, pois, quanto mais estável, mais fácil é desprotonar o composto.\begin{matrix}Letra \ (B)
\end{matrix}
$• \ \text{Alternativa (B):}$ $\color{orangered}{\text{Falsa}}$
A propanona apresenta estrutura trigonal plana, porém, é levemente polar devido a diferença de eletronegatividade do grupo carbonila.
$• \ \text{Alternativa (C):}$ $\color{#3368b8}{\text{Verdadeira}}$
A etilamina é o composto mais básico entre os do enunciado, isto devido a amina primária presente, esta que apresenta um par eletrônico isolado no nitrogênio. Portanto, aminas reagem como bases semelhantemente à amônia, sendo assim, categoricamente básicas.
$\color{orangered}{\text{Obs:}}$ Creio que uma dúvida pode ser: por que não poderia ser a propionamida? Sucintamente, pois a eletronegatividade da carbonila desloca o par eletrônico isolado do nitrogênio para ela. Desse modo, é mais difícil doar o par isolado, justificando-se assim um menor caráter básico que as aminas.
$• \ \text{Alternativa (D):}$ $\color{#3368b8}{\text{Verdadeira}}$
Amidas apresentam um grupo carbonila ligado a um átomo de nitrogênio, como no composto (IV). Por outro lado, aminas se caracterizam por átomos de nitrogênio ligados a resíduos hidrocarbônicos, como no composto (III).
$• \ \text{Alternativa (E):}$ $\color{#3368b8}{\text{Verdadeira}}$
Ácidos carboxílicos não apresentam este nome atoa, veja que a grande diferença de acidez entre os compostos pode ser explicada por seus respectivos íons negativos (bases conjugadas). Nesse contexto, nota-se uma grande diferença de estabilidade entre o íon carboxilato e o íon alcóxido, isto devido a ressonância no íon carboxilato, esta que dissipa a carga negativa do íon, deslocalizando os elétrons de valência e contribuindo para estabilidade. Por outro lado, o íon alcóxido não apresenta ressonância, não havendo expressiva estabilidade, inclusive, muito pelo contrário.
Além disso, não se esqueça que a estabilidade da base conjugada também atribui a força de um ácido, pois, quanto mais estável, mais fácil é desprotonar o composto.\begin{matrix}Letra \ (B)
\end{matrix}

Ampliar Imagem

