No início de uma experiência a bureta do lado esquerdo da figura estava completamente cheia de água. Pela torneira da bureta foi admitido nitrogênio gasoso puro. Após a admissão do nitrogênio o nível de água na bureta ficou na mesma altura que no recipiente do lado direito da figura. A pressão ambiente externa era e a temperatura era . Nesta temperatura a pressão de vapor da água é .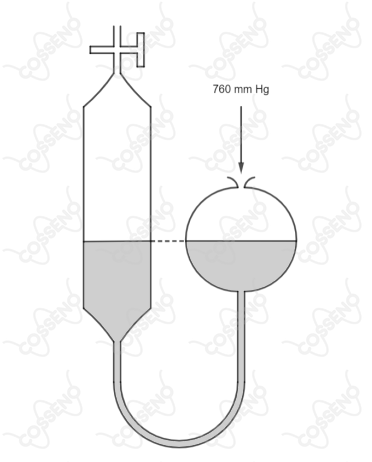
Assinale a afirmação falsa a respeito do volume gasoso dentro da bureta após o estabelecimento do equilíbrio:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

Com conhecimento do $\text{Teorema de Stevin}$, entende-se que pela linha de nível da imagem, todos os pontos situados nela apresentam a mesma pressão. Nesse viés, constata-se que a pressão exercida pelo nitrogênio junto a pressão da água deve ser igual a pressão atmosférica, no caso, $760 \ \pu{mmHg}$. Com isso, pode-se escrever: \begin{matrix} P_{N_2} + P_{H_2O} =760 \ \pu{mmHg} &,& P_{H_2O} =24\ \pu{mmHg} &\Rightarrow&P_{N_2} = 736 \ \pu{mmHg}
\end{matrix}Pensando no número de moléculas ou fração molar, escreve-se para cada caso: \begin{matrix} P_{Total} = k \cdot n_{Total} &,& P_{H_2O} = k \cdot n_{H_2O} &,& P_{N_2} = k \cdot n_{N_2} &|& k = {{\dfrac{R \cdot T}{V}}} = cte
\end{matrix}Assim, relaciona-se:\begin{matrix}
{{\dfrac{n_{N_2}}{n_{Total}} }} = {{\dfrac{736}{760}}} &,&
{{\dfrac{n_{H_2O}}{n_{Total}} }} = {{\dfrac{24}{760}}}
\end{matrix}\begin{matrix} Letra \ (B)
\end{matrix}

