Entre as opções abaixo, todas relativas a orbitais atômicos, assinale aquela que contém a afirmação ERRADA:
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{royalblue}{\text{Correta}}$
Os valores dos números quânticos principal e azimutal (ou secundário) são relativos ao número de nós, ou à distribuição da densidade de probabilidade. Nesse caso, é importante saber que o número quântico principal especifica o número total de nós na nuvem eletrônica.
$\color{orangered}{Obs:}$ Nós são extremidades de superfícies em que a probabilidade de encontrar um elétron é zero.
$• \ \text{Alternativa (B):}$ $\color{orangered}{\text{Errada}}$
O número quântico secundário (ou azimutal) começa no orbital $s$, o qual é representado por $l=0$.
$• \ \text{Alternativa (C):}$ $\color{royalblue}{\text{Correta}}$
Veja que os orbitais $p$ são formados por $\text{lobos}$ e estes estão separados por um nó, o qual apresenta uma superfície nodal plana passando pelo núcleo.
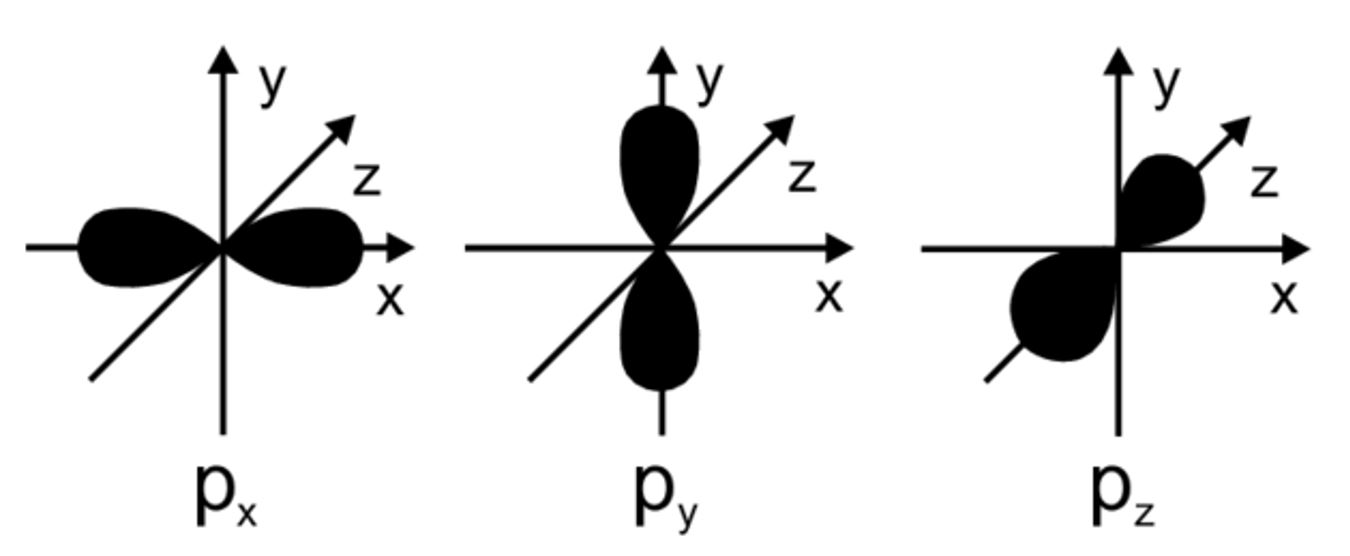 $• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Correta}}$
Orbitais $s$ são esfericamente simétricos.
$• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Correta}}$
Orbitais $s$ são esfericamente simétricos.
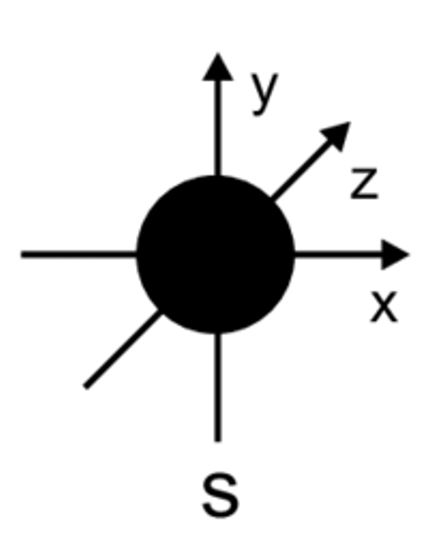 $• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Em orbitais do tipo $s$, nas proximidades do núcleo, maior será densidade de probabilidade de encontrar um elétron, assim, com o aumento da distância ao núcleo, menor a densidade de probabilidade de encontrar o elétron. Além disso, vale ressaltar que, quando a distância ao núcleo tende ao infinito, temos outro nó, o qual a probabilidade de encontrar um elétron é zero.\begin{matrix}Letra \ (B)
\end{matrix}
$• \ \text{Alternativa (E):}$ $\color{royalblue}{\text{Correta}}$
Em orbitais do tipo $s$, nas proximidades do núcleo, maior será densidade de probabilidade de encontrar um elétron, assim, com o aumento da distância ao núcleo, menor a densidade de probabilidade de encontrar o elétron. Além disso, vale ressaltar que, quando a distância ao núcleo tende ao infinito, temos outro nó, o qual a probabilidade de encontrar um elétron é zero.\begin{matrix}Letra \ (B)
\end{matrix}

Ampliar Imagem

Ampliar Imagem

