Um cilindro provido de pistão móvel e de uma torneira para entrada de gases, conforme esquema abaixo, contendo , e , é mantido numa temperatura constante . Uma vez estabelecido o equilíbrio, temos dentro do cilindro: mol de ; mol de e mol de .
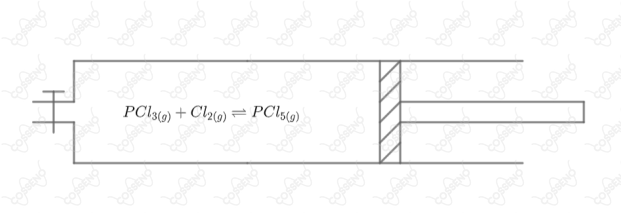
Das opções a seguir, qual é a aquela que resultará numa pressão total final dupla dentro do pistão?
Pergunta 22: Por que a opção b) está certa ou errada?
CossenoGPT
Teste
gratuitamente agora
mesmo! 

$• \ \text{Alternativa (A):}$ $\color{orangered}{\text{Errada}}$
Ignorando-se a reação química, faz sentido, todavia, há uma reação química neste sistema. Veja que, pelo princípio de Le Chatelier, ao aumentarmos a temperatura, iremos deslocar o equilíbrio para o sentido endotérmico - este que é a decomposição do $PCl_5$ - a fim de amenizar o efeito da temperatura. Desse modo, além de aumentarmos a temperatura absoluta, estamos aumentando o número de moléculas no sistema, o que fará a pressão ser maior que a inicial. Pela lei dos gases ideias: \begin{matrix} {{\dfrac{P}{ n \cdot T }}} = cte
&\Rightarrow& {{\dfrac{P_i }{n_i \cdot T_i }}} = {{\dfrac{P_f }{n_f \cdot T_f}}} &\Rightarrow& P_f = 2P_1 \cdot {{(\dfrac{n_f} {n_i})}} &,& n_f \ne n_i &\therefore& P_f \ne 2P_i
\end{matrix}
$• \ \text{Alternativa (B):}$ $\color{orangered}{\text{Errada}}$
Ao reduzir o volume do sistema, a concentração aumenta, assim, novamente, vide o princípio de Le Chatelier, entende-se que a reação tende a diminuir esta concentração, ou seja, o equilíbrio se desloca para produção de $PCl_5$. Com isso, ao passo que diminuímos o volume, também diminuímos o número de mols, consequentemente, a pressão será menor. Analogamente, pela lei dos gases ideias: \begin{matrix} {{\dfrac{P \cdot V}{n}}} = cte
&\Rightarrow& {{\dfrac{P_i \cdot V_i}{n_i}}} = {{\dfrac{P_f \ \cdot \ 0,5V_i}{n_f}}} &\Rightarrow& P_f = 2P_1 \cdot {{(\dfrac{n_f} {n_i})}} &,& n_f \ne n_i &\therefore& P_f \ne 2P_i
\end{matrix}
$• \ \text{Alternativa (C):}$ $\color{orangered}{\text{Errada}}$
Num raciocínio análogo aos anteriores, estamos aumentando a concentração dos compostos em equilíbrio, assim, o sistema tende a diminuir esta concentração, ele fará isso deslocando o equilíbrio para produção de $PCl_5$ (duas moléculas irão formar uma). Com isso, a pressão que se esperava no sistema será minimizada a fim de tentar manter a pressão e concentração inicial, ou seja, a pressão será menor que o dobro.
$• \ \text{Alternativa (D):}$ $\color{royalblue}{\text{Correta}}$
A introdução de gás inerte não irá alterar o equilíbrio da reação, por outro lado, irá alterar a pressão total do sistema, no caso, dobrar, pois estaremos dobrando os mols de gás.
$• \ \text{Alternativa (E):}$ $\color{orangered}{\text{Errada}}$
Claramente a pressão total será maior que o dobro, pode-se dizer que o equilíbrio seja até deixado de lado nessa análise, pois o aumento da temperatura desloca no sentido da decomposição do $PCl_5$, enquanto a diminuição do volume desloca para produção do $PCl_5$. No final, a pressão será aproximadamente quatro vezes maior.\begin{matrix} Letra \ (D)
\end{matrix}

