USP 2022 Química - Questões
Abrir Opções Avançadas
As afirmações a seguir baseiam-se na descrição da $CETESB$ (Companhia Ambiental do Estado de São Paulo):
Afirmação 1: “O dióxido de enxofre $(SO_2)$ é liberado para a atmosfera por gases vulcânicos e fontes antropogênicas, principalmente atividades industriais que processam materiais contendo enxofre, como termelétricas, fabricação de fertilizantes, fundição de alumínio e aço, produção de ácido sulfúrico e papel.”
Afirmação 2: “O dióxido de enxofre é um gás incolor com forte odor pungente. É muito irritante quando em contato com superfícies úmidas, pois se transforma em trióxido de enxofre $(SO_3)$ e passa rapidamente a ácido sulfúrico $(H_2SO_4)$.”
Note e adote:
Distribuição eletrônica: $\textbf{O} = 1s^2, \ 2s^2, \ 2p^4; \ \textbf{S} = 1s^2,\ 2s^2, \ 2p^6,\ 3s^2, \ 3p^4$.
Massas molares $(\text{g/mol}): O = 16; \ S = 32;\ Ca = 40$.
a) Represente a estrutura de Lewis do dióxido de enxofre.
b) A afirmação $2$ refere-se à formação da chuva ácida. Represente a reação balanceada da formação da chuva ácida a partir de $SO_3$ e a reação balanceada da chuva ácida com o carbonato de cálcio $(CaCO_3)$, que é um dos componentes de construções que são danificadas por ela.
c) Considere uma determinada amostra de carvão que contém $1\%$ em massa de enxofre. Quando esse carvão é queimado, o enxofre é convertido em dióxido de enxofre pela reação $S_{(s)} + O_{2(g)} \ \to \ SO_{2(g)}$. Para evitar a poluição do ar, este dióxido de enxofre pode ser tratado com óxido de cálcio para formar sulfito de cálcio, como representado pela reação $SO_{2(g)} + CaO_{(s)} \ \to \ CaSO_{3(s)}$. Calcule a massa diária, em quilogramas, de $CaO$ necessária para tratar o $SO_2$ em uma usina que consome $3,2 \times 10^6 \ \text{kg}$ de carvão por dia.
O quadrinho a seguir mostra uma paródia entre situações cotidianas e descobertas científicas.

Quais feitos científicos de Mendeleev, de Watson e Crick e de Thomson estão relacionados com o quadrinho?
A produção do vidro tem por base a modificação da estrutura cristalina do quartzo ($SiO_2$) por meio do seu aquecimento e da adição de óxidos alcalinos, dentre eles o $Na_2O$. Esse processo adiciona cátions sódio à estrutura do quartzo, tornando-a amorfa. Alguns vidros, como os utilizados em telas de smartphones, passam ainda por processo de troca iônica para aumentar a resistência a quedas e riscos. Para isso, o vidro é banhado em uma solução salina contendo íons potássio. Dessa forma, o potássio substitui o sódio na estrutura, sem que o volume do vidro se altere. Com base nessas informações, é correto afirmar que os íons potássio
Uma das formulações para os adesivos “silicones” usados na construção civil é chamada de “silicone acético”. Essa nomenclatura é utilizada porque o componente ativo libera ácido acético durante a formação do precursor, espécie que promoverá a polimerização, como representado genericamente a seguir.
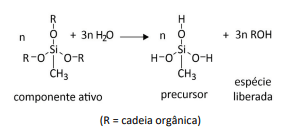
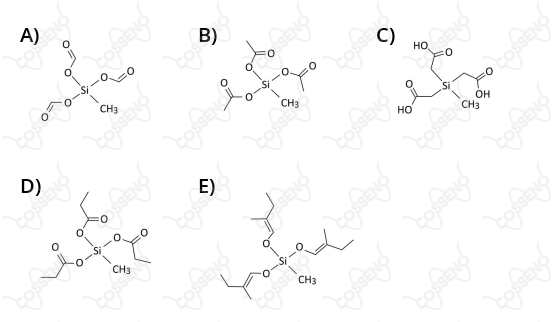
Considerando essas informações, qual dos componentes ativos a seguir faria com que a formulação fosse considerada como “silicone acético”?
Oxigênio ($O_2$) e ozônio ($O_3$) estão em constante processo de consumo e produção na estratosfera, como representado pelas equações químicas a seguir. As reações $I$ e $II$ ilustram etapas da produção de ozônio a partir de oxigênio, e a reação $III$ mostra a restauração de oxigênio a partir de ozônio.
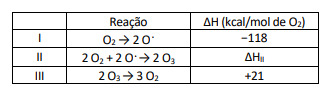
A reação global balanceada, composta pelas etapas $I$ e $II$, que representa a formação de ozônio é:
Carregando...