USP 2017 Química - Questões
Abrir Opções Avançadas
O Brasil produziu, em 2014, 14 milhões de toneladas de minério de níquel. Apenas uma parte desse minério é processada para a obtenção de níquel puro.
Uma das etapas do processo de obtenção do níquel puro consiste no aquecimento, em presença de ar, do sulfeto de níquel $\left(Ni_2S_3\right)$, contido no minério, formando óxido de níquel $\left(NiO\right)$ e dióxido de enxofre $\left(SO_2\right)$. O óxido de níquel é, então, aquecido com carvão, em um forno, obtendo-se o níquel metálico. Nessa última etapa, forma- se, também, dióxido de carbono $\left(CO_2\right)$.
NOTE E ADOTE:
Massa molar $(\text{g/mol}):\ \ \ Ni=58,8;\ \ \ C=12,0;\ \ \ O=16,0.$
a) Considere que apenas 30 % de todo o minério produzido em 2014 foram destinados ao processo de obtenção de níquel puro e que, nesse processo, a massa de níquel puro obtida correspondeu a 1,4% da massa de minério utilizada. Calcule a massa mínima de carvão, em quilogramas, que foi necessária para a obtenção dessa quantidade de níquel puro.
b) Cada um dos gases produzidos nessas etapas de obtenção do níquel puro causa um tipo de dano ambiental. Explique esse fato para cada um desses gases.
Os pneus das aeronaves devem ser capazes de resistir a impactos muito intensos no pouso e bruscas alterações de temperatura. Esses pneus são constituídos de uma câmara de borracha reforçada, preenchida com o gás nitrogênio $\left(N_2\right)$ a uma pressão típica de $30\ atm$ a $27\ ^\circ C$. Para a confecção dessa câmara, utiliza-se borracha natural modificada, que consiste principalmente do poli-isopreno, mostrado a seguir: $$-CH_2-C\left(CH_3\right)=CH-CH_2-CH_2-C\left(CH_3\right)=CH-CH_2-CH_2-C\left(CH_3\right)=CH-CH_2-$$
Em um avião, a temperatura dos pneus, recolhidos na fuselagem, era $-13\ ^\circ C$ durante o voo. Próximo ao pouso, a temperatura desses pneus passou a ser $27\ ^\circ C$, mas seu volume interno não variou.
NOTE E ADOTE:
Massa molar do $N_2=28\ g/mol$
Constante universal dos gases $=0,082\ L\cdot atm\cdot K^{-1}\cdot mol^{-1}$ $K=^\circ C+273$
a) Qual é a pressão interna de um dos pneus durante o voo? Mostre os cálculos.
b) Qual é o volume interno desse mesmo pneu, em litros, dado que foram utilizados 14 kg de $N_2$ para enchê-lo? Mostre os cálculos.
c) Escreva a fórmula estrutural do monômero do poli-isopreno.
Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo.
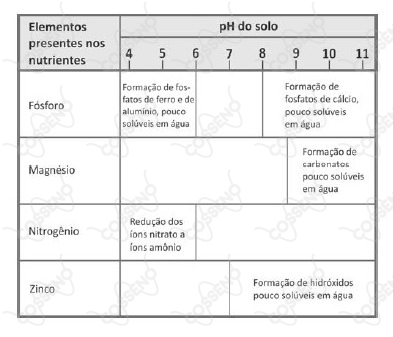
Para que o solo possa fornecer todos os elementos citados na tabela, o seu pH deverá estar entre
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro $\left(FeS_2\right)$, sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas: $$2\ FeS_{2\ \ \left(s\right)}+7\ O_{2\ \ \left(g\right)}+2\ H_2O_{\ \ \left(\ell \right)}\to 2\ Fe^{2+}_{\ \ \left(aq\right)}+4\ SO^{2-}_{4\ \ \left(aq\right)}+4\ H^+_{\ \ \left(aq\right)}$$
$$2\ Fe^{2+}_{\ \ \left(aq\right)}+\dfrac{1}{2}O_{2\ \ \left(g\right)}+2\ H^+_{\ \ \left(aq\right)}\to\ 2 \ Fe^{3+}_{\ \ \left(aq\right)}+H_2O_{\ \ \left(\ell \right)}$$
$$2\ Fe^{3+}_{\ \ \left(aq\right)}+6\ H_2O_{\ \ \left(\ell \right)}\to 2\ Fe{\left(OH\right)}_{3\ \ \left(s\right)}+6\ H^+_{\ \ \left(aq\right)}$$
Considerando a equação química que representa a transformação global desse processo, as lacunas da frase “No intemperismo sofrido pela pirita, a razão entre as quantidades de matéria do $FeS_{2\ \ \left(s\right)}$ e do $O_{2\ \ \left(g\right)}$ é __________, e, durante o processo, o pH do solo __” podem ser corretamente preenchidas por
Um estudante realizou um experimento para avaliar a reatividade dos metais $Pb$, $Zn$ e $Fe$. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:
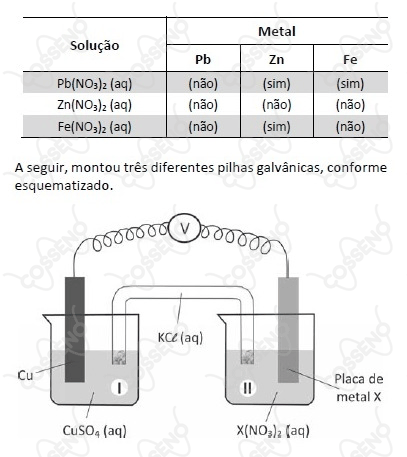
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.

Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de $CuSO_4$ de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em $CuSO_{4\ \ \left(aq\right)}$.
Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais $X$ ($Pb$, $Zn$ ou $Fe$), mergulhada na solução aquosa de seu respectivo nitrato.
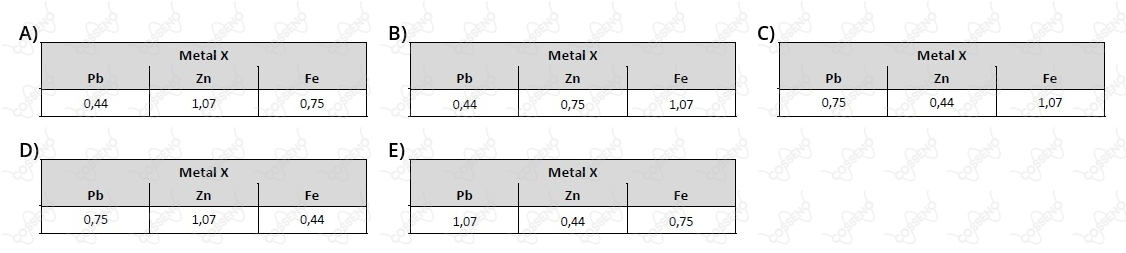
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: $0,44\ V;\ 0,75\ V$ e $1,07\ V$.
A atribuição correta desses valores de força eletromotriz a cada uma das pilhas, de acordo com a reatividade dos metais testados, deve ser
I - Pb
II - Zn
III - Fe
Carregando...