USP 2008 Química - Questões
Abrir Opções Avançadas
Devido à toxicidade do mercúrio, em caso de derramamento desse metal, costuma-se espalhar enxofre no local para removê-lo. Mercúrio e enxofre reagem, gradativamente, formando sulfeto de mercúrio. Para fins de estudo, a reação pode ocorrer mais rapidamente, se as duas substâncias forem misturadas num almofariz. Usando esse procedimento, foram feitos dois experimentos. No primeiro, $5,0\ g$ de mercúrio e $1,0\ g$ de enxofre reagiram, formando $5,8\ g$ do produto, sobrando $0,2\ g$ de enxofre. No segundo experimento, $12,0\ g$ de mercúrio e $1,6\ g$ de enxofre forneceram $11,6\ g$ do produto, restando $2,0\ g$ de mercúrio.
Dados:
Massas molares $\left(g\ mol^{-1}\right)$
Mercúrio $\left(Hg\right)=200$
Enxofre $\left(S\right)=32$
a) Mostre que os dois experimentos estão de acordo com a lei da conservação da massa (Lavoisier) e a lei das proporções definidas (Proust).
b) Existem compostos de $Hg$ (I) e de $Hg$ (II). Considerando os valores das massas molares e das massas envolvidas nos dois experimentos citados, verifique se a fórmula do composto formado, em ambos os casos, é $HgS$ ou $Hg_2S$. Mostre os cálculos.
Um dos métodos industriais de obtenção de zinco, a partir da blenda de zinco, $ZnS$, envolve quatro etapas em sequência:
I. Aquecimento do minério com oxigênio (do ar atmosférico), resultando na formação de óxido de zinco e dióxido de enxofre.
II. Tratamento, com carvão, a alta temperatura, do óxido de zinco, resultando na formação de zinco e monóxido de carbono.
III. Resfriamento do zinco formado, que é recolhido no estado líquido.
IV. Purificação do zinco por destilação fracionada. Ao final da destilação, o zinco líquido é despejado em moldes, nos quais se solidifica.
a) Represente, por meio de equação química balanceada, a primeira etapa do processo.
b) Indique o elemento que sofreu oxidação e o elemento que sofreu redução, na segunda etapa do processo. Justifique.
c) Indique, para cada mudança de estado físico que ocorre na etapa IV, se ela é exotérmica ou endotérmica.
Foram misturados 2,00 L de um alcano de $m$ átomos de carbono por molécula e 2,00 L de outro alcano de $n$ átomos de carbono por molécula, ambos gasosos. Esses alcanos podem ser quaisquer dois dentre os seguintes: metano, etano, propano ou butano. Na combustão completa dessa mistura gasosa, foram consumidos 23,00 L de oxigênio. Todos os volumes foram medidos nas mesmas condições de pressão e temperatura.
a) Escreva a equação da combustão completa de um alcano de $n$ átomos de carbono por molécula. Para identificar os dois alcanos que foram misturados, conforme indicado acima, é preciso considerar a lei de Avogadro, que relaciona o volume de um gás com seu número de moléculas.
b) Escreva o enunciado dessa lei.
c) Identifique os dois alcanos. Explique como chegou a essa conclusão
Para indicar a acidez de uma solução, usa-se o pH, que informa a concentração de íons $H^+$ que se encontram na solução. A água pura tem pH igual a 7, o que significa que existe 1 mol de $H^+$ para cada ${10}^7$ litros. Do mesmo modo, numa solução de pH igual a 3 existe 1 mol de $H^+$ para cada ${10}^3$ litros. Se determinada solução tem pH igual a 6, pode-se concluir que a concentração de íons $H^+$ nessa solução é
Hidrogênio reage com nitrogênio formando amônia. A equação não balanceada que representa essa transformação é:
$$H_{2 \left(g\right)}+N_{2 \left(g\right)}\to NH_{3\left(g\right)}$$
Outra maneira de escrever essa equação química, mas agora balanceando-a e representando as moléculas dos três gases, é:
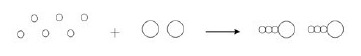
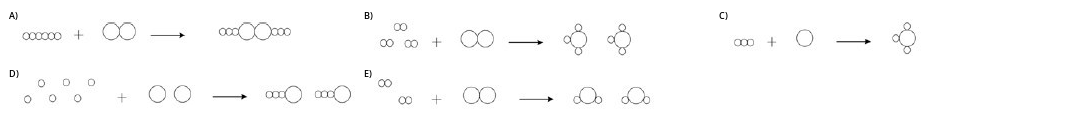
Carregando...