MACK 2011 Química - Questões
Abrir Opções Avançadas
Utilizado para inibir o apetite e ajudar no emagrecimento, o cloridrato de sibutramina pode trazer riscos ao coração e ao sistema nervoso central, segundo afirmação de técnicos da Anvisa (Agência Nacional de Vigilância Sanitária), em audiência pública realizada em 23/02/2011.
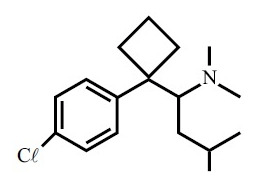
A fórmula estrutural do cloridrato de sibutramina está representada acima e, a respeito da mesma, considere as afirmações:
I) Existe um átomo de carbono terciário com hibridização $sp^{2}$.
II) Sua fórmula molecular é $C_{17} H_{25} NC\ell$.
III) Possui 6 elétrons pi ressonantes.
IV) Apresenta os grupos funcionais haleto orgânico e amida.
Estão corretas, somente,
Uma erupção vulcânica pode gerar produtos sólidos, líquidos ou gasosos. Os gases e vapores dissolvidos no magma são, normalmente, liberados na atmosfera, por meio de vapor de água, gerando fumarolas. Além do vapor de água, são liberados, em quantidades expressivas, os vapores de $SO_{2}$, $CH_{4}$ e $CO_{2}$.
A respeito dessas substâncias, assinale a alternativa correta.
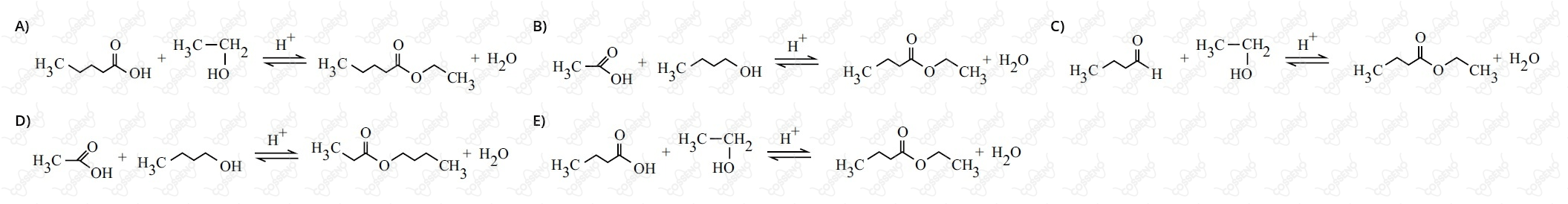
O sabor e o aroma se completam e se confundem, formando uma sensação denominada flavour. Essa palavra de origem inglesa significa a união de sabor e de aroma, dando origem ao termo flavorizante, que está presente nos rótulos de muitas guloseimas. Assim, o flavorizante é um produto orgânico natural ou artificial, sendo que, entre os artificiais, destacam-se os ésteres. Diversos ésteres são utilizados pela indústria alimentícia como flavorizantes, sendo, o butanoato de etila, utilizado para conferir o sabor articial de abacaxi.
Dentre as equações abaixo, assinale a alternativa que representa a síntese do flavorizante de abacaxi.
Na tabela periódica abaixo, alguns elementos químicos foram representados aleatoriamente por algarismos romanos.
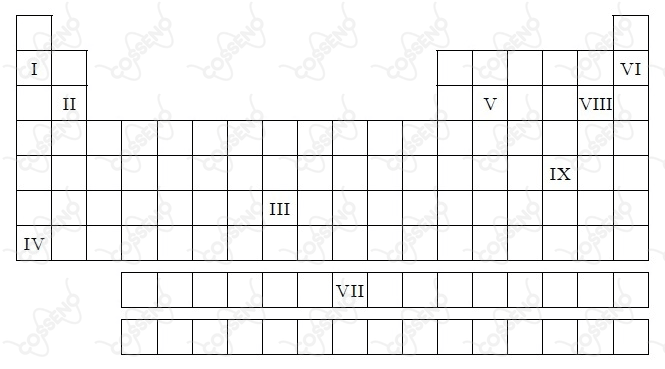
A respeito de tais elementos é correto afirmar que
Para a obtenção do ferro a partir da hematita ($Fe_{2} O_{3}$ no interior de um alto-forno, o gás redutor $\left(CO\right)$ atravessa totalmente a matéria-prima no sentido ascendente, reduzindo o minério de ferro. O processo pode ser simplificadamente representado pela equação química NÃO BALANCEADA:
$$Fe_{2} O_{3} +CO \, \to \, Fe+CO_{2}$$
Considerando o processo acima representado, considere as afirmações I, II, III e IV abaixo.
I) O ferro presente na hematita apresenta número de oxidação igual a $+2$.
II) De acordo com o processo, para cada mol de hematita adicionada, são utilizados 3 mol de monóxido de carbono.
III) Para um rendimento global igual a 50%, a massa de ferro formada a partir de $1280 \, kg$ de hematita é de $448 \, kg$.
IV) O gás carbônico dissolvido em água forma uma solução que apresenta valor de pH maior do que 7.
Dadas as massas molares $\text{g/mol}$: $C=12$, $O=16$ e $Fe=56$.
São corretas, apenas, as afirmações
Carregando...