ITA 2023 - Questões
Abrir Opções Avançadas
Considere as seguintes afirmações relacionadas a átomos e fons atômicos no estado gasoso:
I. A afinidade eletrônica do átomo de oxigênio é maior do que a do anion $\ce{O-}$.
II. A energia de ionização do átomo de oxigênio é maior do que a do anion $\ce{O^{2-}}$.
III. O raio atômico do átomo de oxigênio é maior do que o do anion $\ce{O-}$.
IV. O átomo de oxigênio tem maior afinidade eletrônica e menor energia de ionização do que o átomo de nitrogênio.
Das afirmações I a IV, acima destacadas, são CORRETAS
Considere os seguintes compostos:
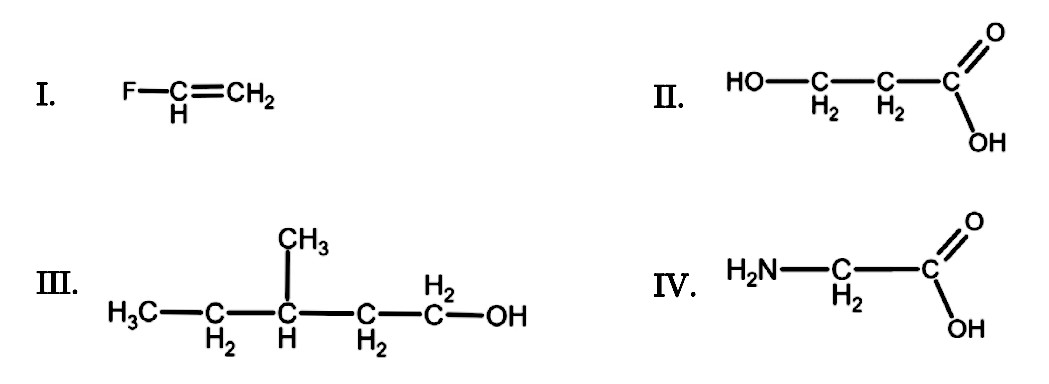
Qual(is) dos compostos acima forma(m) comumente polímeros de condensação?
Um sistema contendo oxigênio atômico (na forma do isótopo estável mais abundante) e hidrogênio atômico (na forma dos dois isótopos mais estáveis) é colocado a reagir em duas condições diferentes, levando à formação de produtos únicos e distintos, $\ce{X}$ e $\ce{Y}$, respectivamente. Considere que $\ce{X}$ e $\ce{Y}$ correspondem a moléculas neutras, estáveis e que obedecem à regra do octeto, e que a massa molar média de $\ce{X}$ é menor do que a de $\ce{Y}$.
Assinale a opção que relaciona corretamente as possíveis razões entre as massas de hidrogênio e de oxigênio nas moléculas que constituem $\ce{X}$ e $\ce{Y}$.
Sabe-se que a constante de velocidade $(k)$ de uma reação é função da temperatura $(T)$ conforme a Lei de Arrhenius: $$k=Ae^{\left(\frac{-E_a}{RT}\right)}$$ em que $A$ é o fator de frequência e $E_a$ é a energia de ativação. Em um estudo cinético, observou-se que a velocidade de uma determinada reação aumenta $1000$ vezes quando a temperatura do meio reacional aumenta de $\pu{400 K}$ para $\pu{500 K}$, permanecendo constantes todos os demais parâmetros iniciais.
Assinale a opção que apresenta a energia de ativação desta reação, em $\pu{kcal mol-1}$, considerando que $A$ e $E_a$ não dependem da temperatura.
Considere que valores maiores de energia de hidratação são observados para íons com menor tamanho e maior carga. Com base nessa informação, são feitas as seguintes comparações entre a energia de hidratação dos pares de íons abaixo.$$\begin{align}&\text{I.}&\ce{Li+ > K+}&\\&\text{II.}&\ce{B^{3+} > Al^{3+}}&\\&\text{III.}&\ce{Sr^{2+} > Ca^{2+}}&\\&\text{IV.}&\ce{Ga^{3+} > Ca^{2+}}&\\&\text{V.}&\ce{S^{2-} > Se^{2-}}&\end{align}$$Das comparações $\text{I}$ a $\text{V}$, acima destacadas, são CORRETAS
Carregando...