ESPCEX 2017 Química - Questões
Abrir Opções Avançadas
Algumas viaturas militares administrativas possuem motores à combustão que utilizam como combustível a gasolina. A queima (combustão) de combustíveis como a gasolina, nos motores à combustão, fornece a energia essencial para o funcionamento dessas viaturas militares. Considerando uma gasolina na condição padrão $(25 ºC$ e $1 atm)$, composta apenas por n-octano $(C_8H_{18})$ e que a sua combustão seja completa (formação exclusiva de $CO_2$ e $H_2O$ gasosos como produtos), são feitas as seguintes afirmativas:
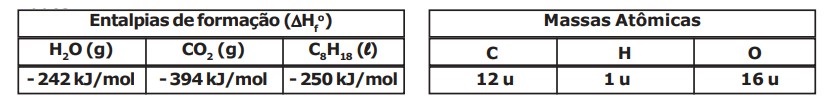
são liberados $16 mols$ de gás carbônico $(CO_2)$; III – a entalpia de combustão (calor de combustão) dessa gasolina é $- 5080 kJ/mol(∆Hc=- 5080 kJ/mol)$; IV – o calor liberado na combustão de $57 g$ de gasolina é de $1270 kJ$. Das afirmativas apresentadas estão corretas apenas a
A emissão de gases derivados do enxofre, como o dióxido de enxofre $\ce{(SO_2)}$, pode ocasionar uma série de problemas ambientais e a destruição de materiais como rochas e monumentos à base de calcita (carbonato de cálcio). Essa destruição ocasiona reações com a emissão de outros gases, como o gás carbônico $\ce{(CO_2)}$, potencializando o efeito poluente. Considerando as equações das reações sucessivas a $27 °C$ e $\ce{1 atm}$, admitindo-se os gases como ideais e as reações completas, o volume de $\ce{CO_2}$ produzido a partir da utilização de $2$ toneladas de $\ce{SO_2}$ como reagente é, aproximadamente,
A gasolina é um combustível constituído por uma mistura de diversos compostos químicos, principalmente hidrocarbonetos. Estes compostos apresentam volatilidade elevada e geram facilmente vapores inflamáveis.
Em um motor automotivo, a mistura de ar e vapores inflamáveis de gasolina é comprimida por um pistão dentro de um cilindro e posteriormente sofre ignição por uma centelha elétrica (faísca) produzida pela vela do motor.
Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono $\ce{(CO)}$ em dióxido de carbono $\ce{(CO2)}$ e a decomposição de óxidos de nitrogênio como o $\ce{NO}$, $\ce{N2O}$ e o $\ce{NO2}$ (denominados $\ce{NOx}$) em gás nitrogênio $\ce{(N2)}$ e gás oxigênio $\ce{(O2)}$.
Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
ao reagir com água
forma o ácido carbônico; $\ce{III}$ - catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles
aumentando a velocidade e também a energia de ativação da reação; $\ce{IV}$ - o $\ce{CO}$ é um óxido básico que
ao reagir com água
forma uma base; $\ce{V}$ - a molécula do gás carbônico $\ce{(CO2)}$ apresenta geometria espacial angular. Das afirmativas feitas estão corretas apenas a
“Sempre que uma substância muda de fase de agregação, a temperatura permanece constante enquanto a mudança se processa, desde que a pressão permaneça constante”.
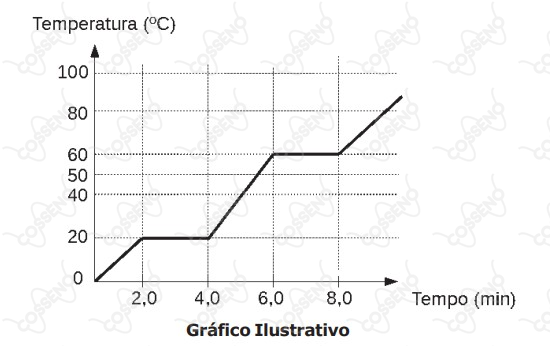
O gráfico abaixo representa a mudança de fase de agregação de uma substância pura com o passar do tempo, em função da variação de temperatura, observada ao se aquecer uma substância $\ce{X}$ durante algum tempo, sob pressão constante.
analise as seguintes afirmativas: I – entre $\ce{0 ºC}$ e $\ce{19 ºC}$
a substância $\ce{X}$ encontra-se na fase sólida; II – o intervalo de $2,0 min$ a $4,0 min$ corresponde à condensação da substância $\ce{X}$; III – a temperatura de $\ce{60 ºC}$ corresponde à temperatura de ebulição da substância $\ce{X}$; IV – no intervalo de $\ce{40 ºC}$ a $\ce{50 ºC}$
a substância $\ce{X}$ encontra-se na fase líquida. Estão corretas apenas as afirmativas
Carregando...