ESPCEX 2015 Química - Questões
Abrir Opções Avançadas
A nitroglicerina é um líquido oleoso de cor amarelo-pálida, muito sensível ao choque ou calor. É empregada em diversos tipos de explosivos. Sua reação de decomposição inicia-se facilmente e gera rapidamente grandes quantidades de gases, expressiva força de expansão e intensa liberação de calor, conforme a equação da reação: $$4 C_{3} H_{5} N_{3} O_{9} (l) \longrightarrow 6 N_{2} (g) + 12 CO_{2} (g) + 10 H_{2}O (g) + O_{2} (g)$$ Admitindo-se os produtos gasosos da reação como gases ideais, cujos volumes molares são iguais a $\pu{24,5 L}$, e tomando por base a equação da reação de decomposição da nitroglicerina, o volume total aproximado, em litros, de gases produzidos na reação de decomposição completa de $\pu{454 g}$ de nitroglicerina será de
Um químico trabalhando em seu laboratório resolveu preparar uma solução de hidróxido de sódio ($\ce{NaOH}$) numa concentração adequada, para posterior utilização em análises titulométricas. Consultando seu estoque verificou a existência de uma solução de $\ce{NaOH}$ de concentração $\ce{0,01 mol \cdot L^{-1}}$, inadequada a seus propósitos. Para a preparação da solução de $\ce{NaOH}$ na concentração adequada, pipetou dez mililitros ($\pu{10 mL}$) dessa solução aquosa de $\ce{NaOH}$ estocada e, em seguida, transferiu o volume pipetado para um balão volumétrico de $\pu{1000 mL}$ de capacidade, completando seu volume com água pura. Considerando que o experimento ocorreu nas condições de $\pu{25 ^\circ C}$ e $\pu{1 atm}$ e que o hidróxido de sódio se encontrava completamente dissociado, o $pH$ dessa solução resultante final preparada pelo Químico será:
O composto representado pela fórmula estrutural, abaixo, pertence à função orgânica dos ácidos carboxílicos e apresenta alguns substituintes orgânicos, que correspondem a uma ramificação como parte de uma cadeia carbônica principal, mas, ao serem mostrados isoladamente, como estruturas que apresentam valência livre, são denominados radicais. (Texto adaptado de: Fonseca, Martha Reis Marques da, Química: química orgânica, pág 33, FTD, 2007).
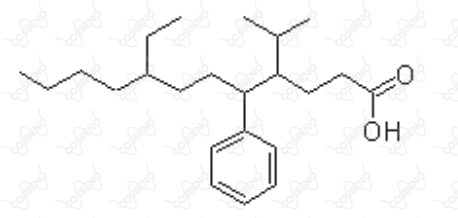
O nome dos substituintes orgânicos ligados respectivamente aos carbonos de número $4$, $5$ e $8$ da cadeia principal, são
Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a ligação entre íons positivos e negativos, unidos por forças de atração eletrostática. (Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225, Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes afirmativas:
I – apresentam brilho metálico.
II – apresentam elevadas temperaturas de fusão e ebulição.
III – apresentam boa condutibilidade elétrica quando em solução aquosa.
IV – são sólidos nas condições ambiente ($\pu{25 ^\circ C}$ e $\pu{1atm}$).
V – são pouco solúveis em solventes polares como a água. Das afirmativas apresentadas estão corretas apenas
O dióxido de enxofre é um dos diversos gases tóxicos poluentes, liberados no ambiente por fornos de usinas e de indústrias. Uma das maneiras de reduzir a emissão deste gás tóxico é a injeção de carbonato de cálcio no interior dos fornos industriais. O carbonato de cálcio injetado nos fornos das usinas se decompõe formando óxido de cálcio e dióxido de carbono. O óxido de cálcio, então, reage com o dióxido de enxofre para formar o sulfito de cálcio no estado sólido, menos poluente.
Assinale a alternativa que apresenta, na sequência em que aparecem no texto (desconsiderando-se as repetições), as fórmulas químicas dos compostos, grifados e em itálico, mencionados no processo.
Carregando...