ESPCEX 2012 Química - Questões
Abrir Opções Avançadas
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em etapas de sínteses químicas, envolvendo o íon dicromato $( \ce {Cr2O7^2-})$ e o ácido oxálico $( \ce {H2C2O4})$:
$$ \ce {Cr2O72- + H2C2O4 + H+ -> Cr^3+ + CO2 + H2O}$$
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução, a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a substância que atua como agente redutor são, respectivamente,
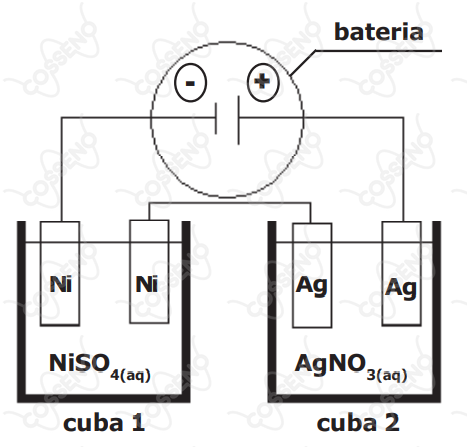
Duas cubas eletrolíticas distintas, uma contendo eletrodos de níquel $( \ce {Ni})$ e solução aquosa de $\ce {NiSO4}$ e outra contendo eletrodos de prata $( \ce {Ag})$ e solução aquosa de $\ce {AgNO3}$, estão ligadas em série, conforme mostra a figura a seguir.
Esse conjunto de cubas em série é ligado a uma bateria durante um certo intervalo de tempo, sendo observado um incremento de $\pu{54 g}$ de massa de prata em um dos eletrodos de prata. Desse modo, o incremento da massa de níquel em um dos eletrodos de níquel é de
Considere as semirreações com os seus respectivos potenciais-padrão de redução dados nesta tabela:
Prata | $\ce{Ag+ (aq) + e- -> Ag^0 (s)}$ | $E^0_{red} = + 0,80 V$ |
Cobre | $\ce{Cu^2+ (aq) + 2e- -> Cu^0 (s)}$ | $E^0_{red} = + 0,34 V$ |
Chumbo | $\ce{Pb^2+ (aq) + 2e- -> Pb^0 (s)}$ | $E^0_{red} = - 0,13 V$ |
Niquel | $\ce{Ni^2+ (aq) + 2e- -> Ni^0 (s)}$ | $E^0_{red} = - 0,24 V$ |
Zinco | $\ce{Zn^2+ (aq) + 2e- -> Zn^0 (s)}$ | $E^0_{red} = - 0,76 V$ |
Magnésio | $\ce{Mg^2+ (aq) + 2e- -> Mg^0 (s)}$ | $E^0_{red} = - 2,37 V$ |
Baseando-se nos dados fornecidos, são feitas as seguintes afirmações:
I – o melhor agente redutor apresentado na tabela é a prata;
II – a reação $\ce{Zn^2+ (aq) + Cu^\circ (s) -> Zn^\circ (s) + Cu^2+ (aq)}$ não é espontânea;
III – pode-se estocar, por tempo indeterminado, uma solução de nitrato de níquel II, em um recipiente revestido de zinco, sem danificá-lo, pois não haverá reação entre a solução estocada e o revestimento de zinco do recipiente;
IV – a força eletromotriz de uma pilha eletroquímica formada por chumbo e magnésio é $\pu{2,24 V}$;
V – uma pilha eletroquímica montada com eletrodos de cobre e prata possui a equação global: $\ce{2 Ag+ (aq) + Cu^\circ (s) -> 2 Ag^\circ (s) + Cu2+ (aq)}$ .
Considere a seguinte reação química em equilíbrio num sistema fechado a uma temperatura constante:
$$\ce{1 H2O(g) 1 C(s) + 31,4 kcal \rightleftarrows 1CO(g) +1 H2(g)}$$
A respeito dessa reação, são feitas as seguintes afirmações:
I – a reação direta trata-se de um processo exotérmico;
II – o denominador da expressão da constante de equilíbrio em termos de concentração molar $(\ce{Kc})$ é igual a $[\ce{H2O}]·[\ce{C}]$;
III – se for adicionado mais monóxido de carbono $(\ce{CO_{(g)}})$ ao meio reacional, o equilíbrio será deslocado para a esquerda, no sentido dos reagentes;
IV – o aumento na pressão total sobre esse sistema não provoca deslocamento de equilíbrio.
Das afirmações feitas, utilizando os dados acima, está(ão) correta(s):
A tabela abaixo cria uma vinculação de uma ordem com a fórmula estrutural do composto orgânico, bem como o seu uso ou característica:
Ordem | Composto Orgânico | Uso ou Característica |
1 | Produção de Desinfetantes e Medicamentos | |
2 | Conservante | |
3 | Essência de Maçã | |
4 | Componente do Vinagre | |
5 | Matéria-Prima para Produção de Plástico |
A alternativa correta que relaciona a ordem com o grupo funcional de cada composto orgânico é:
Carregando...