O cloro comercial é comumente usado na maioria das piscinas com o objetivo de eliminar microrganismos. Uma das formas de aplicá-lo na água da piscina é a partir da adição de compostos contendo o íon hipoclorito ou de ácido tricloroisocianúrico, vulgarmente denominado tricloro, que reage com a água, formando ácido hipocloroso e ácido cianúrico. As estruturas do tricloro e do ácido cianúrico são apresentadas abaixo.

A soma das concentrações do ácido hipocloroso e do íon hipoclorito é chamada de “cloro livre”, e ambas estabelecem um equilíbrio dependente do pH, de acordo com o gráfico abaixo.
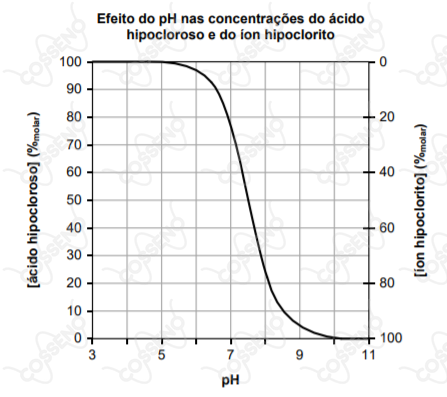
O ácido hipocloroso é oito vezes mais eficiente como agente biocida do que o íon hipoclorito. Quando o pH está baixo, o excesso de ácido hipocloroso favorece a formação de cloraminas, que são irritantes aos olhos dos banhistas. Quando o pH está alto, o poder de eliminação de microorganismos é reduzido. Costuma-se considerar que o pH ótimo para aplicação em piscinas é de .
Uma das vantagens do uso do tricloro é que o ácido cianúrico retarda o processo de fotólise do “cloro livre” quando a água está exposta à ação dos raios ultravioleta. Sem o ácido cianúrico, a meia-vida do “cloro livre” é de min. A adição do tricloro faz com que a perda de “cloro livre” ocorra a uma taxa de por dia. No entanto, o teor máximo recomendado de ácido cianúrico para piscinas é de ppm. Já os teores do ácido hipocloroso e do íon hipoclorito devem ser mantidos, individualmente, entre e ppm.
Em uma piscina residencial de , foram medidos um pH de e um teor de “cloro livre” de ppm. Adicionaram-se então de tricloro, ajustando-se o pH para o valor ótimo.
Com base nas informações acima:
a) determine se, após essa adição, a piscina estará em condições de uso.
b) calcule em quantos dias o limite mínimo de cloro livre será atingido, caso a piscina não seja mais usada.