Considere um recipiente adiabático conforme a ilustração abaixo, no qual de uma solução aquosa de , a em massa, e a uma temperatura inicial , são diluídos a em massa, com água à mesma temperatura. Calcule a temperatura da solução após a diluição.
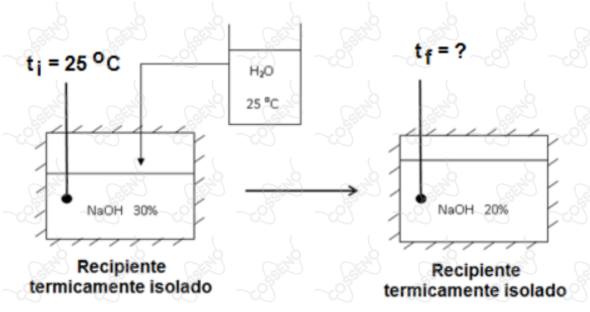
Dados:
- Para o sistema $\text{NaOH}$ – água a $25 \ ^{\circ}C$:
a $30\ \% :, H = 104 \ J/g$ de solução; $c_{P} = 3{,}54 \ J \cdot g^{-1} \cdot ^{\circ}C^{-1}$
a $20\ \% :, H = 76 \ J/g$ de solução; $c_{P} = 3{,}63 \ J \cdot g^{-1} \cdot ^{\circ}C^{-1}$
- Calor específico da água líquida: $c_{P} = 4{,}18 \ J \cdot g^{-1} \cdot ^{\circ}C^{-1}$
- Estado de referência para entalpia: água líquida a $0 \ ^{\circ}C$
- Para o sistema $\text{NaOH}$ – água a $25 \ ^{\circ}C$:
a $30\ \% :, H = 104 \ J/g$ de solução; $c_{P} = 3{,}54 \ J \cdot g^{-1} \cdot ^{\circ}C^{-1}$
a $20\ \% :, H = 76 \ J/g$ de solução; $c_{P} = 3{,}63 \ J \cdot g^{-1} \cdot ^{\circ}C^{-1}$
- Calor específico da água líquida: $c_{P} = 4{,}18 \ J \cdot g^{-1} \cdot ^{\circ}C^{-1}$
- Estado de referência para entalpia: água líquida a $0 \ ^{\circ}C$