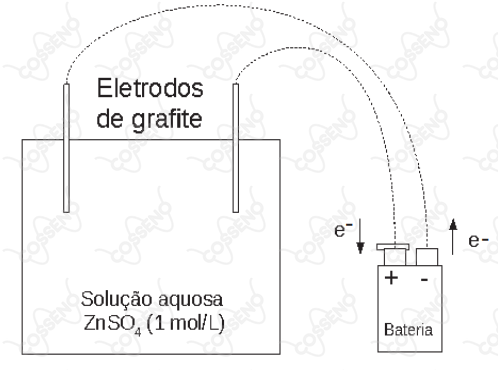
Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade (cuba eletrolítica) coloque cerca de de solução aquosa de sulfato de zinco de concentração . Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante minutos e segundos e observe. Considere o arranjo eletrolítico a e , conforme visto na figura a seguir:
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I – Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II – A semirreação de oxidação que ocorre no ânodo da eletrólise é .
III – Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV – No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V – A massa de zinco metálico obtida no processo de eletrólise será de
Das afirmativas feitas, estão corretas apenas