Neste ano de 2019, foi realizada pelos alunos da EsPCEx uma prática no laboratório de química envolvendo eletrólise com eletrodos ativos conforme a descrição experimental:
- Num béquer de capacidade (cuba eletrolítica) coloque cerca de de solução aquosa de de concentração . Tome como eletrodos uma barra fina de cobre e um prego de ferro. Ligue-os com auxílio de fios a uma fonte externa de eletricidade com uma corrente contínua de intensidade de 3 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. O prego deve ser ligado ao polo negativo da fonte e a barra de cobre ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 16 minutos e 5 segundos e observe.
Considere o arranjo eletrolítico e o sal completamente dissociado, conforme visto na figura a seguir:
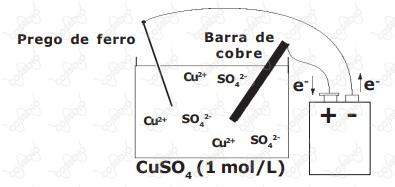
Na discussão apresentada nos relatórios dos diversos grupos de alunos, surgiram as seguintes afirmativas:
Na superfície do prego ocorreu a deposição de cobre metálico.
Durante o processo a barra de cobre se oxida.
A massa de cobre metálico que se depositou na superfície do prego foi de .
A semi-reação de redução que ocorre no cátodo é .
A reação global é .
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.