Para isolar o salicilato de metila sintetizado a partir do ácido salicílico foi adotado o seguinte procedimento:
I destilação para a remoção do metanol não reagido;
II dissolução da mistura restante em éter dietílico, um solvente orgânico volátil;
III lavagens sucessivas da solução etérea com solução aquosa de bicarbonato de sódio (NaHCO3) na concentração de 0,2 mol/L, para neutralizar e remover o catalisador ácido e o ácido salicílico não reagido;
IV secagem da solução etérea com MgSO4 anidro;
V destilação da solução para a remoção do éter.
As lavagens com a solução de bicarbonato de sódio, na etapa III, foram repetidas até que o ácido salicílico não reagido tivesse sido totalmente removido a partir da fração orgânica. Para essa certificação, a fase aquosa, depois de separada da fase orgânica, foi acidificada e, dessa forma, o equilíbrio mostrado a seguir foi deslocado para a direita, e gerou o ácido na forma não ionizada, que pode ser considerado insolúvel em meio aquoso.
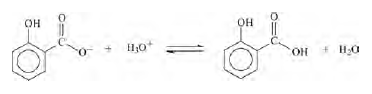
Assim, enquanto a fração aquosa continha o íon salicilato, o ácido precipitava após a acidificação do meio. Terminada a precipitação, considerou-se que não havia mais ácido salicílico na solução e as lavagens puderam ser cessadas.
A partir dessas informações, julgue o item.
A equação a seguir, em que o H2CO3 gerado pode posteriormente decompor-se em CO2 (g) e H2O (l), é a equação balanceada para a reação de neutralização do ácido sulfúrico pelo bicarbonato de sódio.
H2SO4 (aq) + 2NaHCO3 (aq) → 2H2CO3 (aq) + Na2SO4 (aq)