Os espetáculos de fogos de artifício são mais que uma forma de entretenimento: os efeitos e as cores visualizadas resultam de reações entre diferentes sais, agentes oxidantes e redutores. Na pólvora (a carga explosiva dos fogos), agentes oxidantes, como o perclorato de potássio (KClO4), estão misturados com agentes redutores, como o enxofre, o que é responsável pela produção da energia necessária para a explosão.A seguir, são apresentadas as equações químicas não balanceadas= das reações que ocorrem no processo de explosão de determinados tipos de fogos de artifício.
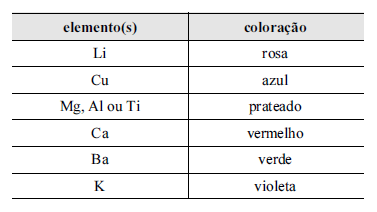
As luzes coloridas emitidas durante a queima de fogos são resultado da luminescência, fenômeno que ocorre quando os elétrons dos átomos dos sais metálicos, previamente excitados pela energia da explosão, retornam aos níveis energéticos de origem, liberando energia na forma de fótons de luz visível. A tabela a seguir mostra alguns elementos e as cores características que eles produzem na luminescência.
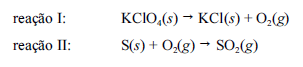
A partir das informações do texto, julgue o item.
Diferentemente dos materiais sólidos incandescentes, cujo espectro de emissão é contínuo, átomos isolados em fase gasosa possuem espectro de emissão descontínuo e característico, com picos estreitos e bem definidos, podendo, contudo, uma ou mais linhas do espectro de emissão de átomos distintos apresentar frequências coincidentes.