Em 1772, o cientista Lavoisier, em seus primeiros trabalhos sobre a combustão, mostrou que determinadas substâncias, como o fósforo, não perdem — mas ganham — massa durante o processo. Onze anos mais tarde, Lavoisier, para decompor a água, elaborou o equipamento ilustrado na figura acima e, utilizando-o, descobriu que a água é uma substância formada por dois elementos: hidrogênio e oxigênio.
Em seu experimento, ele colocou em um recipiente (A) uma massa conhecida de água destilada e a fez passar sobre ferro incandescente (B), promovendo a decomposição da água e a obtenção de gás H2, que foi coletado em um recipiente indeformável (C). A seguinte equação química não balanceada retrata essa reação.
Fe(s) + H2O(l) 6 Fe3O4(s) + H2(g)
Em outro experimento, o gás hidrogênio produzido foi misturado ao gás oxigênio em um balão de vidro — o gasômetro de Lavoisier — e a mistura de gases foi inflamada por uma fagulha elétrica. Pronto: a água líquida tinha sido reconstituída!
Internet:
Considerando o texto acima e os diversos aspectos a ele relacionados, julgue o item.
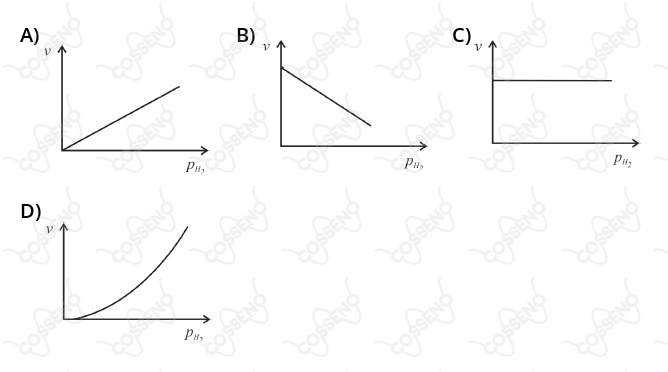
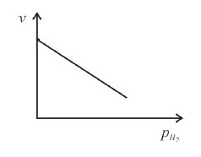
Considere que, nas condições em que a reconstituição da água foi realizada no gasômetro de Lavoisier, tenha ocorrido uma reação cinética elementar e trimolecular. Considerando a lei de velocidade do processo, assinale a opção que apresenta o gráfico que melhor representa a dependência da velocidade (v) da reação em função da pressão parcial (pH2) de gás hidrogênio no interior do gasômetro.