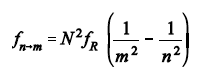
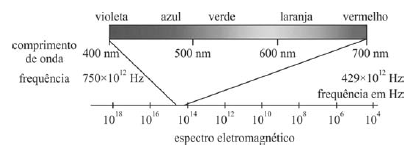
A figura acima esboça o espectro eletromagnético na região do visível ao olho humano. No caso de átomos hidrogenoides (átomo de hidrogênio ou íons atômicos com apenas um elétron), a frequência do fóton emitido é dada pela relação a seguir, em que N é o número de prótons no núcleo atômico, m e n são números inteiros maiores que zero, e fR = 3,3×1015 é a frequência de Rydberg.
Nesse modelo, fluorescência é definida como o fenômeno quântico que ocorre quando um átomo absorve um fóton com comprimento de onda na região do ultravioleta (UV) e emite fótons na região do visível, devido às transições eletrônicas internas ao átomo.
A partir dessas informações, julgue o item a seguir, considerando que um íon He+, no estado fundamental, tenha absorvido um fóton com comprimento de onda na UV, o que proporciona uma transição eletrônica entre os níveis eletrônicos n = 1 → n = 4. Desconsidere o recuo do átomo He+.
De acordo com a teoria ondulatória da luz, as ondas com comprimento de onda no espectro eletromagnético propagam-se no vácuo, excetuando-se aquelas cujo comprimento de onda se situa na região de ondas de rádio.