[1] A palavra "átomo" cunhada pelos gregos, mas,
nas primeiras décadas do século XIX, não havia evidência
experimental de que a matéria fosse composta de átomos. (...)
[4] Em 1827, o naturalista inglês Robert Brown
observou que grãos de pólen boiando em um copo de água
se movimentavam constantemente, em um zigue-zague
[7] caótico, sem que nenhuma força os empurrasse. Brown
chegou a achar que o pólen estivesse vivo, mas recuou em
seguida: o efeito era o mesmo com pó de granito. Ali estava
[10] um mistério para ser resolvido. Alguns cientistas, no entanto,
especularam que o movimento browniano fosse causado pelo
choque aleatório entre as moléculas que compunham o
[13] sistema. Anos depois, Albert Einstein cogitou que, embora
os átomos fossem pequenos demais para serem observados,
seria possível estimar o seu tamanho calculando-se seu
[16] impacto cumulativo em objetos “grandes” — como um grão
de pólen. Se a teoria atômica estivesse certa, então deveria
ser possível, analisando-se o movimento das partículas
[19] “grandes” (chamado movimento browniano), calcular as
dimensões físicas dos átomos.
Einstein assumiu que o movimento aleatório das
[22] partículas em suspensão era causado pela colisão de trilhões
e trilhões de moléculas de água e computou o peso e o
tamanho dos átomos, dando a primeira prova experimental
[25] de existência deles. Einstein foi além: calculou que um
grama de hidrogênio continha 3,03 × 1023 átomos, valor
surpreendentemente próximo do real. Sua fórmula foi
[28] confirmada em 1908 pelo francês Jean Perrin. Abria-se ali o
mundo do muito pequeno.
Internet:
Tendo o texto como referência inicial e considerando os múltiplos aspectos que ele suscita, julgue o item.
Segundo o modelo de Bohr, o átomo é considerado um núcleo de prótons e nêutrons com elétrons orbitando à sua volta. Dessa forma, um elétron teria velocidade tangencial em torno do núcleo de módulo igual a 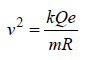 é a constante eletrostática, Q é a carga do núcleo, e é a carga do elétron, R é o raio de órbita do elétron e m é sua massa.
é a constante eletrostática, Q é a carga do núcleo, e é a carga do elétron, R é o raio de órbita do elétron e m é sua massa.