USP 2013 Química - Questões
Abrir Opções Avançadas
O ácido gama-hidroxibutírico é utilizado no tratamento do alcoolismo. Esse ácido pode ser obtido a partir da gamabutirolactona, conforme a representação a seguir:
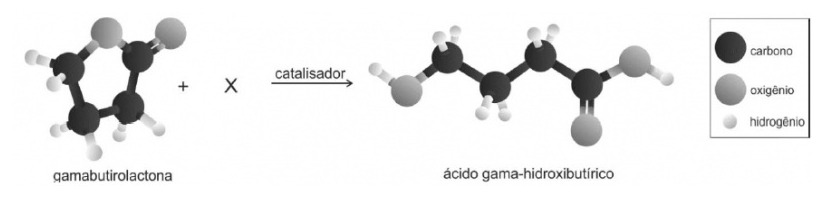
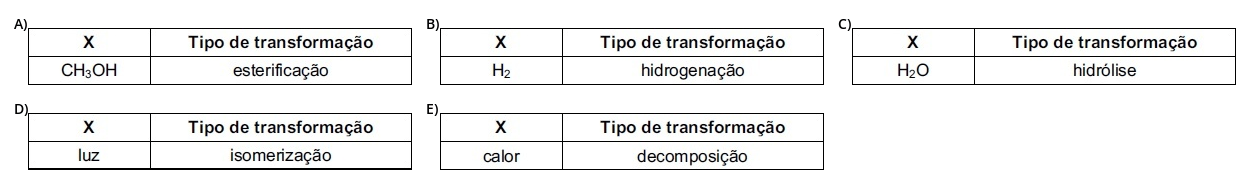
Assinale a alternativa que identifica corretamente X (de modo que a representação respeite a conservação da matéria) e o tipo de transformação que ocorre quando a gamabutirolactona é convertida no ácido gama-hidroxibutírico.
I. X
II. Tipo de transformação
A reação do tetracloroetano $\left(C_2H_2C{\ell }_4\right)$ com zinco metálico produz cloreto de zinco e duas substâncias orgânicas isoméricas, em cujas moléculas há dupla ligação e dois átomos de cloro. Nessas moléculas, cada átomo de carbono está ligado a um único átomo de cloro.
a) Utilizando fórmulas estruturais, mostre a diferença na geometria molecular dos dois compostos orgânicos isoméricos formados na reação.
b) Os produtos da reação podem ser separados por destilação fracionada. Qual dos dois isômeros tem maior ponto de ebulição? Justifique.
O craqueamento catalítico é um processo utilizado na indústria petroquímica para converter algumas frações do petróleo que são mais pesadas (isto é, constituídas por compostos de massa molar elevada) em frações mais leves, como a gasolina e o GLP, por exemplo. Nesse processo, algumas ligações químicas nas moléculas de grande massa molecular são rompidas, sendo geradas moléculas menores.
A respeito desse processo, foram feitas as seguintes afirmações:
I. O craqueamento é importante economicamente, pois converte frações mais pesadas de petróleo em compostos de grande demanda.
II. O craqueamento libera grande quantidade de energia, proveniente da ruptura de ligações químicas nas moléculas de grande massa molecular.
III. A presença de catalisador permite que as transformações químicas envolvidas no craqueamento ocorram mais rapidamente.
Está correto o que se afirma em
A porcentagem em massa de sais no sangue é de aproximadamente 0,9%. Em um experimento, alguns glóbulos vermelhos de uma amostra de sangue foram coletados e separados em três grupos. Foram preparadas três soluções, identificadas por $X$, $Y$ e $Z$, cada qual com uma diferente concentração salina. A cada uma dessas soluções foi adicionado um grupo de glóbulos vermelhos. Para cada solução, acompanhou- se, ao longo do tempo, o volume de um glóbulo vermelho, como mostra o gráfico.
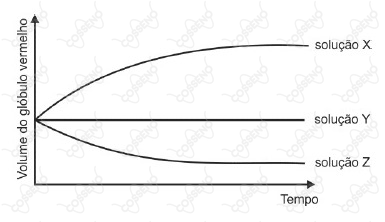
Com base nos resultados desse experimento, é correto afirmar que
A partir de considerações teóricas, foi feita uma estimativa do poder calorífico (isto é, da quantidade de calor liberada na combustão completa de $1\ kg$ de combustível) de grande número de hidrocarbonetos. Dessa maneira, foi obtido o seguinte gráfico de valores teóricos:
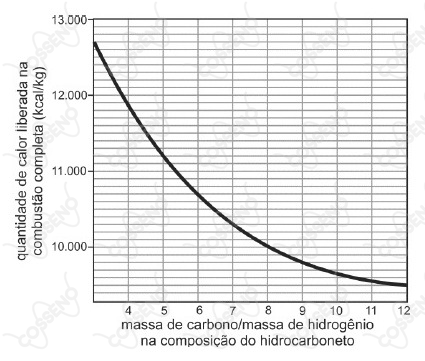
Com base no gráfico, um hidrocarboneto que libera $10.700\ kcal/kg$ em sua combustão completa pode ser representado pela fórmula
Dados:
Massas molares ($g/mol$): $C=12,0$; $H=1,00$.
Carregando...