UNESP 2016 Química - Questões
Abrir Opções Avançadas
Em um laboratório, uma estudante sintetizou sulfato de ferro(II) hepta-hidratado ($FeSO_4\cdot 7H_2O$) a partir de ferro metálico e ácido sulfúrico diluído em água. Para tanto, a estudante pesou, em um béquer, $14,29\ g$ de ferro metálico de pureza 98,00%. Adicionou água destilada e depois, lentamente, adicionou excesso de ácido sulfúrico concentrado sob agitação. No final do processo, a estudante pesou os cristais de produto formados.
Para a síntese do sulfato de ferro(II) hepta-hidratado, após a reação entre ferro metálico e ácido sulfúrico, a estudante deixou o béquer resfriar em banho de gelo, até a cristalização do sal hidratado. A seguir, a estudante separou o sólido por filtração, o qual, após ser devidamente lavado e secado, apresentou massa igual a $52,13\ \text{g}$. Dadas as massas molares $(g\cdot \ \text{mol}^{-1}):\ Fe = 56,0;\ S = 32,0;\ H = 1,0;\ O = 16,0$, escreva a equação balanceada da reação global de formação do sulfato de ferro(II) hepta-hidratado sintetizado pela estudante e calcule o rendimento da reação a partir do ferro metálico e do ácido sulfúrico.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de $3000^\circ$C. Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
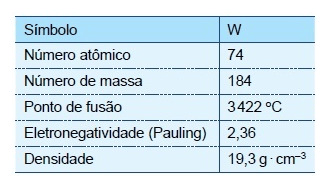
A partir das informações contidas no texto, é correto afirmar que a propriedade que justifica adequadamente o uso do tungstênio em lâmpadas incandescentes é:
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de $3000^\circ$C. Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
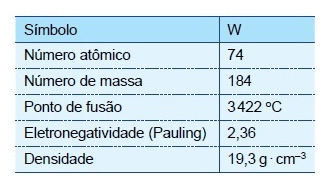
A partir das informações contidas na tabela, é correto afirmar que o átomo neutro de tungstênio possui
A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:
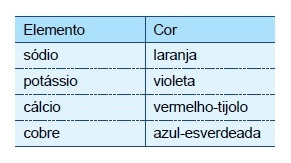
Em 1913, Niels Bohr (1885-1962) propôs um modelo que fornecia uma explicação para a origem dos espectros atômicos. Nesse modelo, Bohr introduziu uma série de postulados, dentre os quais, a energia do elétron só pode assumir certos valores discretos, ocupando níveis de energia permitidos ao redor do núcleo atômico. Considerando o modelo de Bohr, os diferentes espectros atômicos podem ser explicados em função
A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:
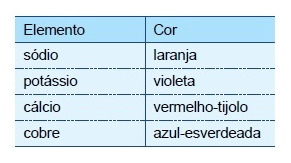
Uma estudante preparou $10,0\ mL$ de uma solução $1,00\ mol\cdot L^{-1}$ de cloreto de um dos metais apresentados na tabela do texto a fim de realizar um teste de chama em laboratório. No teste de chama houve liberação de luz vermelha intensa. A partir das informações contidas no texto e utilizando a classificação periódica dos elementos, assinale a alternativa que apresenta a massa do sal utilizado pela estudante, em gramas, e a sua fórmula.
Carregando...